Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ta có: dhỗn hợp/H2 = 4,44 ⇒ Mhỗn hợp = 4,44.2 = 8,88
Gọi nCH4 ban đầu là là 1
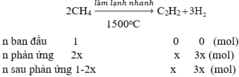
Tổng số mol khí sau phản ứng: 1 - 2x + x + 3x = 1 + 2x (mol)
MX = 2. 4,44 = 8,88
Áp dụng định luật bảo toàn khối lượng ta có:
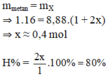

Gọi số mol CH4 ban đầu là 1 (mol), số mol phản ứng là a (mol)
PTHH: 2CH4--to, làm lạnh nhanh--> C2H2 + 3H2
Trc pư: 1 0 0
Pư: a--------------------------->0,5a--->1,5a
Sau pư: (1-a) 0,5a 1,5a
=> \(\Sigma n=\left(1-a\right)+0,5a+1,5a=1+a\left(mol\right)\)
\(m_X=m_{CH_4\left(bđ\right)}=1.16=16\left(g\right)\)
=> \(\overline{M}_X=\dfrac{16}{1+a}=5.2=10\)
=> a = 0,6 (mol)
=> \(H\%=\dfrac{0,6}{1}.100\%=60\%\)

Đáp án C
BTKL: nđ.Mđ=ns.Ms=>nđ.16=0,08.10=>nđ=0,05 mol
=>n tăng=0,08-0,05=0,03 mol
2CH4 → C2H2+3H2 tăng 2 mol
0,015 tăng 0,03
=>nBr2=2nC2H2=0,03 mol =>mBr2=4,8 gam

* Trích mỗi chất một ít ra để làm thí nghiệm .
- Dẫn các mẫu thử qua nước vôi trong :
+ Mẫu thử làm nước vôi trong vẩn đục là khí CO2
CO2 + Ca(OH)2 →→CaCO3 + H2
+ Mẫu thử không xảy ra phản ứng là khí hidro , etilen, metan , nito. ( Nhóm 1 )
- Dẫn các mẫu thử ở Nhóm 1 qua bột Đồng (II) oxit màu đen :
+ Mẫu thử nào làm bột Đồng (II) oxit từ màu đen chuyển sang màu đỏ là khí hidro .
CuO + H2 →→Cu + H2O
+ Mẫu thử không xảy ra phản ứng là khí etilen , nito , metan ( Nhóm 2 )
- Cho các mẫu thử ở nhóm 3 tác dụng với khí oxi :
+ Mẫu thử có chất tạo thành là khí cacbon dioxit và nước là khí metan
CH4 +2O2 →→ CO2 + 2H2O
C2H4+3o2--->2CO2+2H2O
+ Mẫu thử không xảy ra phản ứng là khí nito .
Sau đó ta cho hỗn hợp còn laij vào Br2
có 1 khí làm Br2 mất màu là C2H4
còn lại là CH4
B)
- Cho H2O vào các mẫu thử, sau đó cho quỳ tím vào:+ Quỳ tím hóa xanh là khí NH3
+ Quỳ tím hóa đỏ là khí HCl +quỳ tím hoá đỏ NHẠT là CO2
+ Không hiện tượng là CH4,C2H4,C2H2
- Metan (CH4) có phản ứng thế vì phân tử chỉ có liên kết đơn
- Etilen(C2H4), axetilen(C2H2) có phản ứng cộng vào liên kết kém bền trong liên kết đôi và liên kết ba
Dùng dd AgNO3/ NH3 trước , rồi dùng dd KMnO4(thuốc tím)
PTHH:
tác dụng dd AgNO3/ NH3 cho màu Mầu vàng nhạt suy ra
C2H2 + AgNO3 + NH3 → C2HAg↓ + NH4NO3
làm mất màu dd KMnO4(thuốc tím) suy ra
3C2H4 + KMnO4 + 4H2O → 3C2H4(OH)2 + 2MnO2 + 2KOH

a) CH3COONa + NaOH\(\xrightarrow[t]{CaO}\) CH4 + Na2CO3
CH4+ Cl2 -> CHCl3 +HCl
b) C4H10 \(\xrightarrow[xt]{t}C_3H_6+CH_4\)
CH4 + O2-> CO2 +H2O
CO2 +Ca(OH)2-> CaCO3 +H2O
C) Al4C3 + H2O -> Al(OH)3 + CH4
CH4 \(\xrightarrow[lamlanhnhanh]{1500^0}\) C2H2 +H2
p/s: làm tới đây thôi ,tự cân bằng

Đáp án C
Bảo toàn khối lượng: mCH4 ban đầu = mX = 0,08 × 5 × 2 = 0,8(g).
⇒ nCH4 ban đầu = 0,8 ÷ 16 = 0,05 mol || Lại có: nπ sinh ra = ∆n.
||⇒ nBr2 phản ứng tối đa = nπ sinh ra = 0,03 mol ⇒ mBr2 = 4,8(g)

Gọi nH2 = a mol ; nC3H6 = b mol
Coi nhh X = 1 mol ⇒ a +b = 1 (1)
Gọi Hiệu suất = a
\(M_X=\frac{2a+42a}{a+b}=\frac{2a+42a}{1}=11.2=22\left(2\right)\)
\(PTHH:C_3H_6+H_2\underrightarrow{^{xt,to}}C_3H_8\)
Ban đầu:___b__________a _____(mol)
Phản ứng:__b n__ bn ____bn____(mol)
Sau phản ứng_b-bn __a-bn ___ bn__(mol)
\(n_{hh\left(spu\right)}=n_{H2\left(dư\right)}+n_{C3H8}+n_{C3H6}=a-bn+bn+b-bn=a+b-bn\left(mol\right)\)
\(M_Y=\frac{m_{H2}+m_{C3H8}+m_{C3H6}}{n_{hh}}=\frac{2a+42bn+42a-42bn}{a+b-bn}=\frac{55}{3}.2=\frac{110}{3}\left(3\right)\)
\(\left(1\right)+\left(2\right)+\left(3\right)\Rightarrow\left\{{}\begin{matrix}a=0,5\\b=0,5\\n=8=80\%\end{matrix}\right.\)
Vậy hiệu suất là 80%

CH4 + 2H2O  CO2 + 4H2
CO2 + 4H2
CH4 + 2O2 (kk)  CO2 + 2H2O nên còn lại N2
CO2 + 2H2O nên còn lại N2
N2 + 3H2 ⇔ 2NH3
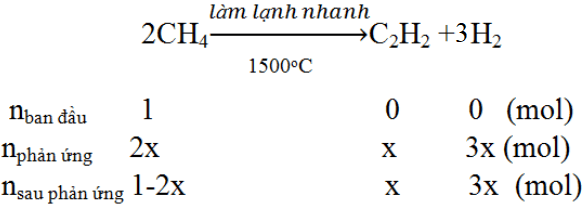
Đáp án B
Hướng dẫn Phương trình phản ứng:
2 C 2 H 4 → 1500 C 0 , l à m l ạ n h n h a n h C 2 H 2 + 3 H 2 B a n đ ầ u : 1 m o l P / ư : x s a u p / ư : 1 - x x 2 3 x 2
M - = 16 . ( 1 - x ) + 26 . x 2 . 2 . 3 x 2 1 - x + x 2 + 3 x 2
=> x = 0,6
=> Vậy hiệu suất chuyển hóa là 60%