

Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



HD:
Zn + CuSO4 ---> ZnSO4 + Cu
x x mol
Gọi x là số mol Zn đã phản ứng. Khối lượng thanh Zn giảm = khối lượng Zn đã phản ứng trừ đi khối lượng Cu sinh ra bám vào thanh Zn.
Do đó: 65x - 64x = 0,15 suy ra x = 0,15 mol = số mol CuSO4. Do đó, CM = 0,15/0,5 = 0,3 M.


Thực hiện các thí nghiệm sau:
A. Nhiệt phân AgNO3
B. Điện phân dung dịch kcl
C. Điện phân dung dịch CuSO4
D. Cho Fe vào dung dịch CuSO4
E. Cho Zn vào dung dịch FeCl3 (dư)
f. Cho Ba vào dung dịch CuSO4 (dư)
Số thí nghiệm thu được kim loại sau khi các phản ứng kết thúc
A. 2
B. 5
C.4
D. 3

3.NO2 nhé
nNO2= 0,06 mol
PTHH:
Cu + 4HNO3→ Cu(NO3)2 + 2NO2+ 2H2O
x__________________________2x
Al+ 6HNO3→ Al(NO3)3+3NO2+3H2O
y______________________3y
Giải HPT:
\(\left\{{}\begin{matrix}64x+27y=1,23\\2x+3y=0,06\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=,015\\y=0,01\end{matrix}\right.\)
%Cu=\(\frac{0,015.64}{1,23}\text{.100%=78,048 %}\)
1.
Gọi số mol Mg và Al là a và b
nH2=0,4
Mg+2HCl\(\rightarrow\)MgCl2+H2
2Al+6HCl\(\rightarrow\)2AlCl3+3H2
Giải HPT:\(\left\{{}\begin{matrix}\text{ 24a+27b=7,8}\\\text{a+1,5b=0,4}\end{matrix}\right.\rightarrow\left\{{}\begin{matrix}a=0,1\\b=0,2\end{matrix}\right.\)
\(\rightarrow\)%mMg=\(\frac{0,1.24}{7,8}\)=30,77%
2.
Gọi số mol Zn, Al là a và b
3Zn+8HNO3\(\rightarrow\)3Zn(NO3)2+2NO+4H2O
Al+4HNO3\(\rightarrow\)Al(NO3)3+NO+2H2O
nNO=0,4
Giải HPT:
\(\left\{{}\begin{matrix}\text{65a+27b=11,9}\\\frac{2a}{3}\text{+b=0,4}\end{matrix}\right.\rightarrow\left\{{}\begin{matrix}a=\frac{11}{470}\\\frac{271}{705}\end{matrix}\right.\)
\(\rightarrow\)%mZn=\(\frac{65.\frac{11}{470}}{11,9}\)=12,78%

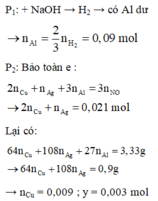
Trong 6,66g B có : 0,018 mol Cu ; 0,006 mol Ag ; 0,18 mol Al
Dung dịch C + HCl không tạo kết tủa → không có Ag+
+) Dung dịch D + thanh Fe
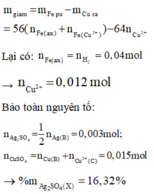
Đáp án A