Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn đáp án D
dùng Ba(OH)2 dư vào dung dịch xảy ra các phản ứng:
• Ba(OH)2 + FeCl2 → Fe(OH)2↓ + BaCl2
• Ba(OH)2 + CuSO4 → BaSO4↓ + Cu(OH)2↓.
• 4Ba(OH)2 + 2AlCl3 → Ba(AlO2)2 + 3BaCl2 + 4H2O
⇒ các kết tủa thu được gồm Fe(OH)2; Cu(OH)2 và BaSO4.
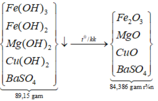
Nung các kết tủa trong không khí: BaSO4 ―t0→ BaSO4.
4Fe(OH)2 + O2 ―t0→ 2Fe2O3 + 4H2O || Cu(OH)2 ―t0→ CuO + H2O
⇒ chất rắn X thu được cuối cùng là Fe2O3; CuO và BaSO4. Chọn D.

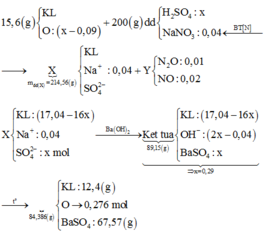
Đặt khối lượng kim loại trong hỗn hợp ban đầu là m gam; số mol O trong hoonx hợp ban đầu là a mol; số mol H2SO4 là b mol.
![]()
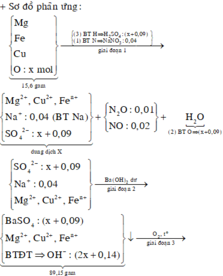
Sơ đồ phản ứng:
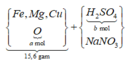
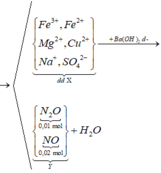
![]()
![]()
Các quá trình tham gia phản ứng của H+: 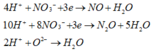
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
*Xét giai đoạn nung kết tủa đến khối lượng không đổi:
Sơ đồ phản ứng:
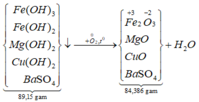
![]()
![]()
![]()
![]()
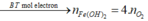
![]()
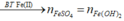
![]()
![]()
![]()
![]() = 85%.
= 85%.
Đáp án A.

Sản phẩm cuối cùng sẽ chỉ có Fe2O3, bảo toàn Fe
=> n Fe2O3 = 0,45=> m = 72 gam
=> Đáp án D

Đáp án B
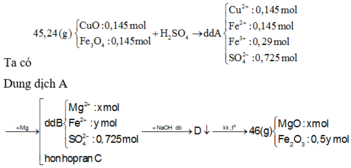
Ta có: m R a n = 46 = 40x+160.0,5y (1)
Bảo toàn điện tích ở dung dịch B: 2x+2y = 2.0,725 (2)
Giải (1) và (2) ta được: x = 0,3 mol , y = 0,425 mol
→ m = 0,3 . 24 = 7,2 (g) → giá trị gần nhất 7,4 (g)


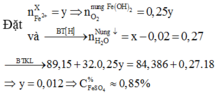


Chọn B.