Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Giải
| Có liên kết đôi | Làm mất màu dd Brom | Phản ứng trùng hợp | Tác dụng với oxi | |
| Metan | không | không | không | có |
| Etilen | có 1 liên kết đôi | có | có | có |


Phương trình hóa học của các phản ứng:
Pb(NO3)2 + Na2CO3 → 2NaNO3 + PbCO3↓
Pb(NO3)2 + 2KCl → 2KNO3 + PbCl2↓
Pb(NO3)2 + Na2SO4 → 2NaNO3 + PbSO4↓
BaCl2 + NaCO3 → 2NaCl + BaCO3↓
BaCl2 + Na2SO4 → 2NaCl + BaSO4↓
| Na2CO3 | KCl | Na2SO4 | NaNO3 | |
| Pb(NO3)2 | x | x | x | o |
| BaCl2 | x | o | x | o |
Phương trình hóa học của các phản ứng:
Pb(NO3)2 + Na2CO3 → PbCO3 ↓ + 2NaNO3
Pb(NO3)2 + 2KCl → PbCl2 ↓ + 2KNO3
Pb(NO3)2 + Na2SO4 → PbSO4 ↓ + 2NaNO3
BaCl2 + Na2CO3 → BaCO3 ↓ + 2NaCl
BaCl2 + Na2SO4 → BaSO4 ↓ + 2NaCl.

31 / Cả A và D đều ko kết tủa
36/ C vì Na2O + HCl -> NaCl + H2O
37/ D vì Ag yếu hơn H2 nên ko đẩy đc
49/ mình ko biết làm :((
50/ 2Fe(OH)3 -> Fe2O3 + 3H2O
=> Fe2O3 là chất rắn
số mol của Fe2O3 là : n = m / M = 24 / ( 56*2 + 16*3 ) = 24 / 160 = 0,15 mol
Theo pthh =>> số mol của Fe(OH)3 là : 0,15 * 2 = 0,3 mol
khối lượng của Fe(OH)3 là : m = n*M = 0,3 * ( 56+ 17*3) = 0,3 * 107 = 32,1 gam
=>> x = 32,1 gam
hình như là sai đáp án cho sai rồi bạn

\(n_{MgCO3}=\dfrac{8,4}{84}=0,1\left(mol\right)\)
a) Pt : \(2CH_3COOH+MgCO_3\rightarrow\left(CH_3COO\right)_2Mg+CO_2+H_2O|\)
2 1 1 1 1
0,2 0,1 0,1 0,1
b) \(n_{CH3COOH}=\dfrac{0,1.2}{1}=0,2\left(mol\right)\)
⇒ \(m_{CH3COOH}=0,2.60=12\left(g\right)\)
\(C_{ddCH3COOH}=\dfrac{12.100}{200}=6\)0/0
\(n_{\left(CH3COO\right)2Mg}=\dfrac{0,1.1}{1}=0,1\left(mol\right)\)
⇒ \(m_{\left(CH3COO\right)2Mg}=0,1.142=14,2\left(g\right)\)
\(m_{ddspu}=8,4+200-\left(0,1.44\right)=204\left(g\right)\)
\(C_{dd\left(CH3COO\right)2Mg}=\dfrac{14,2.100}{204}=6,96\)0/0
Chúc bạn học tốt

gọi a là số mol của kẽm tham gia phản ứng:
PTHH: Zn+ CuSO4 \(\rightarrow\)ZnSO4 + Cu
a mol\(\rightarrow\)a mol \(\rightarrow\) a mol
theo đề bài cho độ giảm khối lượng của bản kẽm sau phản ứng là:
mZn tan - mCu bám = 65a- 64a = 50 - 49,81 = 0,18 ( mol)
a) khối lượng của kẽm tham gia phản ứng:
m= n x M = 0,18 x 65 = 11,7 (g)
b) Khối lượng của CuSO4 là
m= n x m = 0,18 x 160 = 28,8 g
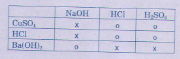

Tham khảo:
Metan:
(1) Công thức cấu tạo:
HIH−C−HIH
(2) Đặc điểm cấu tạo của phân tử:
Phân tử metan có 4 liên kết đơn.
(3) Phản ứng đặc trưng: Phản ứng thế
Ví dụ: CH4+Cl21:1−→asCH3Cl+HCl
(4) Ứng dụng chính:
- Làm nhiên liệu trong đời sống và sản xuất.
- Dùng để điều chế bột than và nhiều chất khác.
Etilen
(1) Công thức cấu tạo:
H−C=C−HIIHH
(2) Đặc điểm cấu tạo của phân tử:
- Phân tử có 44 liên kết đơn C−HC−H và 11 liên kết đôi C=CC=C.
- Liên kết đôi C=CC=C này kém bền dễ bị đứt trong các phản ứng hóa học.
(3) Phản ứng đặc trưng: Phản ứng cộng
Ví dụ: C2H4+Br2→C2H4Br2
(4) Ứng dụng chính:
- Sản xuất nhựa: PE, PVC, ..
- Sản xuất axit axetic, rượu etylic, đicloetan
- Kích thích quả mau chính
axetilen đâu bạn