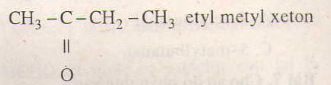Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đề đây:
a, Hãy lập công thức tính % về khối lượng C, H của monoxicloankan theo số lượng nguyên tử cacbon trong phân tử. nhận xét kết quả thu được.b, cũng hỏi như câu (a) đối với ankan. Hàm lượng % C, H ở ankan CnH2n+2 sẽ biến đổi như thế nào khi n tiến tới vô cùng. a) mono xicloankan: CnH2n
%C=12/14.100% =85,71%
%H = 14,29%
=> %C và H luôn là hằng số và ko thay đổi theo số C
b) CnH2n+2
%C = 12n/(14n+2)
%H = (2n+2)/(14n+2)
nếu e đã học giới hạn trong toán thì dễ dàng tính đc, còn không thì cứ nghĩ như thế này, n rất lớn so với 2 nên 14n+2 = 14n => %C tiến về 85,71%
%H--->14,2857%
Viết phương trình dạng phân tử ứng với phương trình ion rút gọn sau :
1. Ba2+ + C BaC03
2. Fe3+ + 3O Fe(OH)3
3. N + O NH3 +H20
4. + 2H+ H2S #Hỏi cộng đồng OLM #Hóa học lớp 11

1. BaSO4+Na2CO3→BaSO4+Na2CO3→BaCO3+Na2SO4BaCO3+Na2SO4
2. 2FeCl3+3Ba(OH)2→2FeCl3+3Ba(OH)2→2Fe(OH)3+3BaCl22Fe(OH)3+3BaCl2
3. (NH4)2SO4+2KOH→(NH4)2SO4+2KOH→2NH3+2H2O+K2SO42NH3+2H2O+K2SO4
4. FeS+2HCl→FeS+2HCl→H2S+FeCl2H2S+FeCl2
5. NaOH+HClO→NaClO+H2ONaOH+HClO→NaClO+H2O
6. CO2+2NaOH→Na2CO3+H2O

- X là anđehit đơn chức
RCHO + 2AgNO3 + 3NH3 + H2O → RCOONH4 + 2Ag + 2NH4NO3
nAg = 0.02 mol => nRCHO = \(\dfrac{1}{2}\) nAg = 0,01 mol
MRCHO = 58,0 g/mol. R là C2H5 , X là CH3CH2CHO.

nH2=11,2/22,4=0,5 mol
nH2O=13,5/18=0,75 mol
\(CH2=CH-CHO\)+\(H2\) => \(CH3CH2CH2OH\)
\(Na+H2O\rightarrow NaOH+\frac{1}{2}H_2\)
0,75 mol\(\Leftarrow\)0,75 mol \(\Rightarrow\)0,375 mol
\(CH3CH2CH2OH\)+\(Na\rightarrow CH3CH2CH2ONa+\frac{1}{2}H2\)
0,25 mol\(\Leftarrow\) 0,25 mol\(\Leftarrow\) 0,25 mol\(\Leftarrow\) 0,125 mol
n\(CH3CH2CH2ONa\) =0,25 (mol)= n\(CH3CH2CH2OH\)
=>m\(CH3CH2CH2OH\)=60.0,25=15g
C% của X=15/(15+13,5).100%=52,63%
\(\rightarrow A\)
nH2=11,2/22,4=0,5 mol
nH2O=13,5/18=0,75 mol
CH2=CH−CHO+ H2 => CH3CH2CH2OH
0,25 mol
Na + H2O => NaOH + ½ H2H2
0,75 mol<=0,75 mol =>0,375 mol
CH3CH2CH2OH + Na =>CH3CH2CH2ONa. +½ H2
0,25 mol<= 0,25 mol<= 0,25 mol<= 0,125 mol
nCH3CH2CH2ONa=0,25 mol=nCH3CH2CH2OH
=>mCH3CH2CH2OH=60.0,25=15g
C% của X=15/(15+13,5).100%=52,63% chọn A

Theo thuyết A-rê-ni-ut thì:
– Axit là chất khi tan trong nước phân li ra cation H+
Ví dụ: HCl → H+ + Cl–
– Bazơ là chất khi tan trong nước phân li ra anion OH–
Ví dụ : NaOH → Na+ + OH–
– Hiđroxit lưỡng tính là hiđroxit khi tan trong nước vừa có thể phân li như axit, vừa có thể phân li như bazơ.
Zn(OH)2 ⇔ Zn2+ +20H– ; Zn(OH)2 ⇔ ZnO2-2 + 2H+
2. Những axit mà tan trong nước phân li nhiều nấc ra ion H+ gọi là các axit nhiều nấc.
Ví dụ : H2SO4, H3PO4….
Những bazơ khi tan trong nước phân li nhiều nấc ra ion OH– gọi là các bazơ nhiều nấc. Ví dụ : Mg(OH)2, Ca(OH)2,….
3. Muối là hợp chất, khi tan trong nước phân li ra cation kim loại (hoặc cation NH4+) và anion gốc axit. Ví dụ : Na2CO3 → 2Na+ + CO32-
Muối trung hòa là muối mà anion gốc axit không có khả năng phân li ra ion H+. Muối axit là muối mà anion gốc axit có khá năng phân li ra ion H+.
Sự điện li cùa muối trong nước tạo cation kim loại (hoặc NH4+ , ion phức) và anion gốc axil.

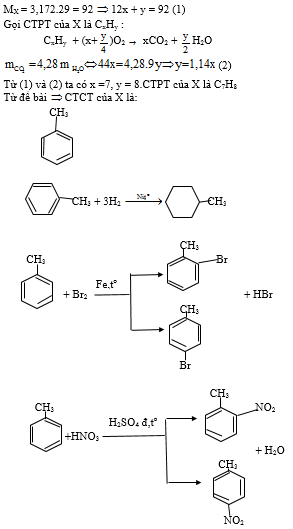
Gọi CTHH là \(C_xH_y\).
\(\Rightarrow12x+y=3,17\cdot29\left(1\right)\)
Giả sử có 1 mol X.
\(C_xH_y+\left(x+\dfrac{1}{4}y\right)O_2\underrightarrow{t^o}xCO_2+\dfrac{1}{2}yH_2O\)
1 \(x\) \(\dfrac{1}{2}y\)
\(\dfrac{m_{CO_2}}{m_{H_2O}}=\dfrac{44x}{18\cdot\dfrac{1}{2}y}=4,28\Rightarrow y=1,14x\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=7\\y=8\end{matrix}\right.\Rightarrow C_7H_8\)

\(3FeO+10H^++NO_3^-\rightarrow3Fe^{3+}+NO+5H_2O\)
x mol =>10x/3 mol=>x/3 mol
Gọi nFeO=x mol
=>nNaNO3=nNO3−=x/3 mol
mFeO+mNaNO3=72x+85/3x=15,05
=>x=0,15 mol
nH+=nHCl=10x/3=0,5 mol
3FeO +10H+ +NO3− => 3Fe3+ + NO + 5H2O
x mol =>10x/3 mol=>x/3 mol
Gọi nFeO=x mol
=>nNaNO3=nNO3−=x/3 mol
mFeO+mNaNO3=72x+85/3x=15,05
=>x=0,15 mol
nH+=nHCl=10x/3=0,5 mol
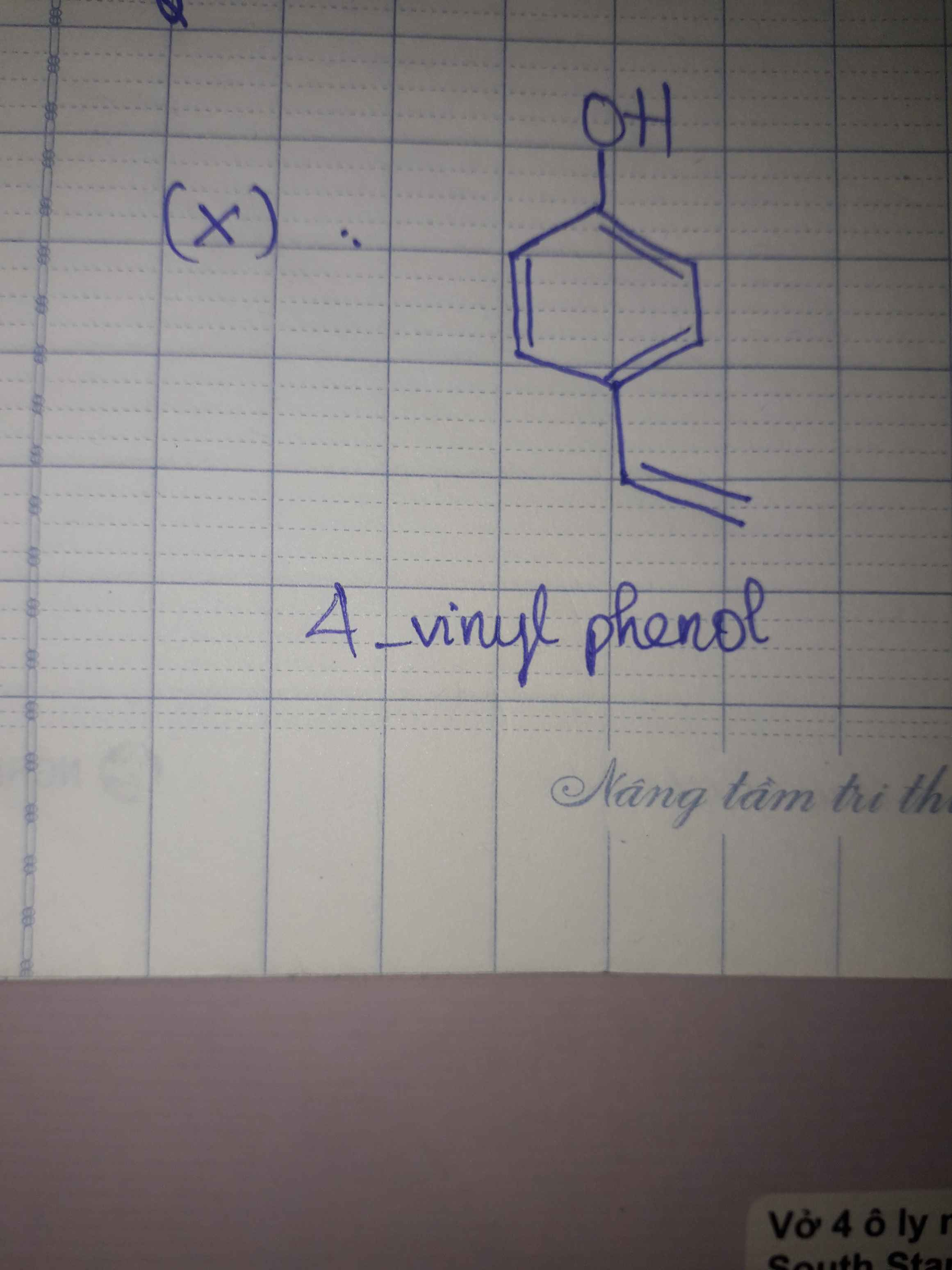
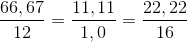 = 4 :8 : 1
= 4 :8 : 1