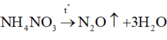Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Ta có  => Phải có một phi kim có Z
≤
4
=> Phải có một phi kim có Z
≤
4
Do đó nguyên tố này chỉ có thể là H
Hai phi kim còn lại thuộc cùng 1 chu kì và thuộc 2 phân nhóm chính liên tiếp.
Gọi số proton của 2 nguyên tố đó lần lượt là Z và Z + 1
TH1: A có 2 nguyên tử H
Ta có:
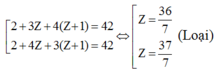
TH2: A có 3 nguyên tử H:
Ta có:
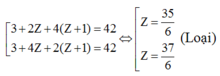
TH3: A có 4 nguyên tử H:
Ta có:
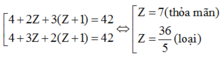
Hai nguyên tố còn lại là N (Z = 7) và O (Z = 8)
Công thức phân tử của A là: N2H4O3 hay NH4NO3
Nhận xét các đáp án:
A đúng: phân tử khối của A là 80 chia hết cho 5.
B sai: Trong phân tử A chứa liên kết ion liên kết cộng hóa trị và liên kết cho nhận
C đúng: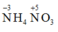 nên trong các phản ứng hóa học A vừa thể hiện tính khử vừa thể hiện tính oxi hóa
nên trong các phản ứng hóa học A vừa thể hiện tính khử vừa thể hiện tính oxi hóa
D đúng: 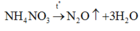

Dựa vào hiệu độ âm điện, trong:
* Na2O: liên kết ion.
* MgO: liên kết ion.
* HBr: liên kết công hóa trị phân cực.
* CaBr2: liên kết ion.

3. Khối lượng mol của hợp chất đó là :
2.28 = 56 (g/mol)
mC = \(\frac{56.85,7}{100}\approx48\left(g\right)\)
mH = 56 - 48 = 8 (g)
nC = \(\frac{48}{12}=4\left(mol\right)\)
nH = \(\frac{8}{1}=8\left(mol\right)\)
Vậy công thức hóa học là C4H8.

Các bạn ơi giúp mình với. Chuyên đề này sáng mai mình phải nộp rồi! Cảm ơn các bạn nhiều!

a) Tổng số electron là 7, suy ra số thứ tự của nguyên tố là 7. Có 2 lớp electron suy ra nguyên tố ở chu kì 2. Nguyên tố p có 5 electron ở lớp ngoài cùng nên thuộc nhóm VA. Đó là ni tơ. Công thức phân tử hợp chất với hidro là NH3
b) Công thức electron và công thức cấu tạo của phân tử NH3
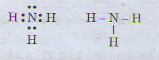
Đáp án B
Ta có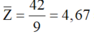
Phải có một phi kim có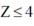
Do đó nguyên tố này chỉ có thể là H
Hai phi kim còn lại thuộc cùng 1 chu kì và thuộc 2 phân nhóm chính liên tiếp.
Gọi số proton của 2 nguyên tố đó lần lượt là Z và Z + 1
TH1: A có 2 nguyên tử H
TH2: A có 3 nguyên tử H:
TH3: A có 4 nguyên tử H:
⇒ Hai nguyên tố còn lại là N (Z = 7) và O (Z = 8)
⇒ Công thức phân tử của A là: N2H4O3 hay NH4NO3
Nhận xét các đáp án:
A đúng: phân tử khối của A là 80 chia hết cho 5.
B sai: Trong phân tử A chứa liên kết ion liên kết cộng hóa trị và liên kết cho nhận
C đúng: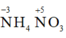 nên trong các phản ứng hóa học A vừa thể hiện tính khử vừa thể hiện tính oxi hóa
nên trong các phản ứng hóa học A vừa thể hiện tính khử vừa thể hiện tính oxi hóa
D đúng: