Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
* Hỗn hợp gồm kim loại M, Fe, FeCO3 tác dụng với dung dịch HNO3 thu được 2 khí không màu trong đó có 1 khí hóa nâu ngoài không khí nên 2 khí là NO và CO2
Tính được nCO2=0,05 mol, n(NO)=0,15 mol nên n(FeCO3)=n(CO2)=0,05 mol.
Đặt nM=a mol, nên n(Fe)=b mol. Ta có: aM+56b+116.0,05=14,1
Nên aM+56b=8,3 (1)
- Dung dịch X2 có : a mol M(NO3)n; (b+0,05) mol Fe(NO3)3, HNO3 dư, có thể có c mol NH4NO3.
+ Phản ứng trung hòa:
HNO3+NaOH→NaNO3+H2O
n(NaOH)= n (HNO3dư)=0,2.1=0,2 mol
- dung dịch X3 có a mol M(NO3)n,( b+0,05) mol Fe(NO3)3, 0,2 mol NaNO3, có thể c mol NH4NO3.
* Cô cạn ½ dung dịch X3, tổng khối lượng chất rắn thu được là:
(M+62n)a+242(b+0,05)+80.c+85.0,2=38,3.2=76,6
aM+62an+242b+80c=47,5 (2)
* Cho dung dịch NaOH dư và ½ dung dịch X3 thu được kết tủa của một chất đó là Fe(OH)3
Fe(NO3)3+3NaOH→3NaNO3+Fe(OH)3
Ta có: 107(b+0,05)=16,05 suy ra b=0,1
Theo bảo toàn electron, ta có: an+ 0,3+0,05=0,45+8c suy ra an=0,1+8c (5)
Từ (1) suy ra aM=2,7 (6)
Từ (2) aM+62an+80c=23,3 (7)
Từ (5), (6), (7) an=0,3; c=0,025 M=9n n=3; M=27 là Al là nghiệm thỏa mãn.
n(HNO3 phản ứng)=nN(sp)=0,1.3+0,15.3+0,025.2+0,15=0,95mol
n(HNO3 bắt đầu)=0,95+0,2=1,15 mol x= CM(HNO3)=2,3M.

a) Đặt \(\hept{\begin{cases}n_{Al}=x\left(mol\right)\\n_{Cu}=y\left(mol\right)\end{cases}}\)
PTHH : \(2Al+3H_2SO_4-->Al_2\left(SO_4\right)_3+3H_2\) (1)
\(Al+6HNO_3-->Al\left(NO_3\right)_3+3NO_2+3H_2O\) (2)
\(Cu+4HNO_3-->Cu\left(NO_3\right)_2+2NO_2+2H_2O\) (3)
Theo pthh (1) : \(n_{Al}=\frac{2}{3}n_{H_2}=0,2\left(mol\right)\) => \(x=0,2\left(mol\right)\)
Theo ptr (2); (3) : \(n_{NO_2}=3n_{Al}+2n_{Cu}\)
=> \(0,8=0,2\cdot3+2\cdot n_{Cu}\)
=> \(n_{Cu}=0,1\left(mol\right)\)
=> \(a=0,2\cdot27+0,1\cdot64=11,8\left(g\right)\)
b) PTHH : \(NH_3+HNO_3-->NH_4NO_3\) (4)
\(3NH_3+3H_2O+Al\left(NO_3\right)_3-->Al\left(OH\right)_3\downarrow+3NH_4NO_3\) (5)
\(2NH_3+2H_2O+Cu\left(NO_3\right)_2-->Cu\left(OH\right)_2\downarrow+2NH_4NO_3\) (6)
BT Al : \(n_{Al\left(OH\right)_3}=n_{Al}=0,2\left(mol\right)\)
BT Cu : \(n_{Cu\left(OH\right)_2}=n_{Cu}=0,1\left(mol\right)\)
=> \(m\downarrow=m_{Al\left(OH\right)_3}+m_{Cu\left(OH\right)_2}=25,4\left(g\right)\)
c) Gọi tên KL là X .
PTHH : \(2Al\left(NO_3\right)_3-t^o->Al_2O_3+6NO_2+\frac{3}{2}O_2\) (7)
\(Cu\left(NO_3\right)_2-t^o->CuO+2NO_2+\frac{1}{2}O_2\) (8)
\(4NO_2+O_2+2H_2O-->4HNO_3\) (9)
\(3X+4nHNO_3-->3X\left(NO_3\right)_n+nNO+2nH_2O\) (10)
viết ptr rồi, nhưng mik có thắc mắc là cho khí B hấp thụ vô nước => tính đc số mol của hno3, rồi áp vô X là ra, nhưng đề lại cho số mol NO =((( hoặc có thể dùng số mol NO để tính nhưng như thế có hơi thừa ko ? tính ra theo 2 cách thì cx ra 2 kq khác nhau ? ai githich giùm mik, hay mik tính sai hoặc phân tích đề sai nhỉ ?? :D

Gọi a và b lần lượt là số mol của nhôm và của nhôm nitrat.
mX=mnhôm nitrat ⇔ 27a+213b=\(\dfrac{a+b}{2}\).102 ⇔ b=\(\dfrac{4}{27}\)a.
BTe: 3nnhôm=3nNO=3.0,81 ⇒ nnhôm=a=0,81 mol ⇒ b=nnhôm nitrat=0,12 mol.
Rắn khan trong Y chỉ chứa Al(NO3)3 (0,81+0,12=0,93 (mol)) với khối lượng là 0,93.213=198,09 (g).
Chọn B.

Bài 1:
A + Cl2 → ACl2 (1)
Fe + ACl2 → FeCl2 + A (2)
x x x (mol)
gọi số mol của Fe phản ứng với một số mol của ACl2 là x
khối lương thanh sắt sau phản ứng là:11,2 - 56x + xMA = 12
=> x =
Ta có:
= 0,25.0,4 = 0,1 (mol)
=> MA = 64 g/mol; Vậy kim loại A là Cu
= nCu =
= 0,2 (mol) =>
= 0,5M
bài 2:
(C17H35COO)3C3H5 + 3NaOH -> 3 C17H35COONa + C3H5(OH)3
890 kg 918 kg
x kg 720 kg
=> x = 698,04 kg.
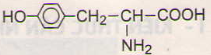 với các chất sau:
với các chất sau:
Đáp án C