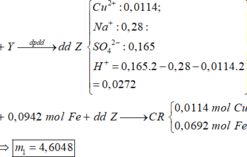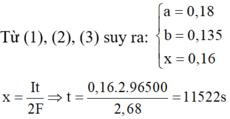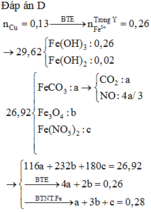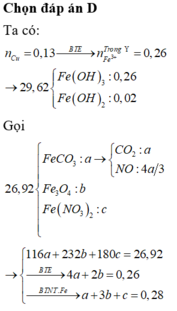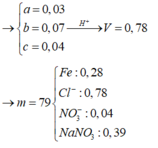Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
Khí gồm SO2 ; CO2 có n = 0,25 mol và M = 55,2g
=> nSO2 = 0,14 ; nCO2 = 0,11 mol
=> nNa2SO3 = 0,14 ; nCuCO3 = 0,11
Gọi thể tích dung dịch axit là V => nHCl = V ; nH2SO4 = 0,5V mol
=> nH2O =1/2 nH+ = V mol
Bảo toàn khối lượng : mX + maxit = mchất tan + mkhí + mH2O
=> V = 0,33 lit
=> nHCl = 0,33 ; nH2SO4 = 0,165 mol
Bảo toàn điện tích : nNa+ + 2nCu2+ = nCl- + 2nSO4 => nCu2+ = 0,19 mol
=> nCuO = 0,19 – 0,11 = 0,08 mol => m = 37,68g
, nCu2+ đp = 0,19.0,94 = 0,1786 mol
Catot : Cu2+ + 2e -> Cu
Anot : 2Cl- -> Cl2 + 2e
2H2O -> 4H+ + O2 + 4e
=> 2nCu2+ đp = nCl- + nH+ => nH+ = 0,0272 mol
Lấy nFe = 0,0942 mol phản ứng với Z( 0,0272 mol H+ và 0,0114 mol Cu2+)
=> sau phản ứng có : 0,0114 mol Cu và 0,0692 mol Fe dư
=> m1 = 4,6048g
=>D

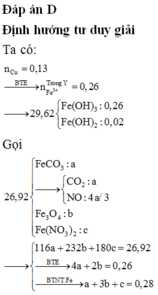
Chọn C
nCuCO3 = nCO2 = 0,11 mol
nNa2SO3 = nSO2 = 0,14 mol
Thể tích dung dịch axit là x lít => nHCl = x và nH2SO4 = 0,5x => nH2O = x
BTKL:36,5x+98.0,5x+m=m+8,475+0,25.55,2+18x => x = 0,33
Dung dịch Y chứa SO42- (0,165), Cl- (0,33), Na+ (0,28) => nCu2+ = 0,19 => nCuO = 0,08
=> m = 37,68 và nFe = 0,0942
nCu2+ bị đp = 0,19.94% = 0,1786
=> n e trao đổi = nCl- + 4nO2 => nO2 = 0,068
=> nH+ = 4nO2 = 0,0272
Fe với dung dịch Z: nFe pư = nCu2+ + nH+/2 = 0,025
=> m1 = mFe dư + mCu = 4,6048 gam

Đáp án A
Nhận thấy, nFe2+(dd Y) = nNO2 – 2nH2 = 0,39 – 2.0,04 = 0,31 mol
Giả sử nHCl = 2a; nH2SO4 = a
nBaSO4 = a, nAgCl = 4a, nAg = nFe2+ = 0,31 => 233a + 143,5.4a + 0,31.108 = 211,02 => a = 0,22
BTNT H => nHCl + 2nH2SO4 = 2nH2 + 2nH2O => nH2O = (0,44 + 2.0,22 – 2.0,04)/2 = 0,4 mol
BTKL: m = mX + mHCl + mH2SO4 – mH2 – mH2O = 29,68 + 0,44.36,5 + 0,22.98 – 0,04.2 – 0,4.18 = 60,02 gam

Trong X có : nFe3O4 = 0,03 mol ; nCuO = 0,02 mol
Khi phản ứng với HCl vừa đủ thì trong dung dịch có :
0,02 mol Cu2+ ; 0,03 mol Fe2+ ; 0,06 mol Fe3+ ; 0,28 mol Cl- .
Khi điện phân :
+/ Anot : 2Cl- → Cl2 + 2e
+/ Catot : Fe3+ + 1e → Fe2+ (1)
Cu2+ + 2e → Cu (2)
Fe2+ + 2e → Fe (3)
Nếu dung dịch chỉ giảm khối lượng vì Cl2 bay ra , chỉ xảy ra (1) ở Catot
=> ne trao đổi = 0,06 mol => mCl2 = 2.13g < 11,18g =>Loại
Nếu (10 và (20 xảy ra vừa đủ => ne trao đổi = 0,1 mol
=> mgiảm = mCl2 + mCu = 4,83g < 11,18 =>Loại
Vậy xảy ra cả (1) ; (2) ; (3)
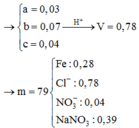
Đặt nFe2+ phản ứng = a mol
=> ne trao đổi = (0,1 + 2a) mol => nCl2 = (0,05 + a) mol
=>mGiảm = 0,02.64 + 56a + 71.(0,05 + a) = 11,18
=> a = 0,05 mol
=>nFe2+ dư = 0,03 + 0,06 – 0,05 = 0,04 mol
Khi phản ứng với KMnO4 tạo MnSO4 ; Fe2+ bị OXH thành Fe3+
Bảo toàn e : nFe2+ = 5nKMnO4 => 0,04 = 5.0,1V
=>V = 0,08 l = 80 ml
=>B