Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C

Giả sử hỗn hợp đầu có 1 mol etilen và 3 mol H2. Hiệu suất tính theo etilen
nH2 pư = n etilen pư = 1.75/100 = 0,75 mol
nY = nX – nH2 pư = 4 – 0,75 =3,25 mol
BTKL: mX = mY => nX.MX = nY.MY => 4.8,5 = 3,25.MY => MY = 136/13 => dY/H2 = 5,23.

Đáp án C
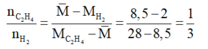
Giả sử hỗn hợp đầu có 1 mol etilen và 3 mol H2. Hiệu suất tính theo etilen
nH2 pư = n etilen pư = 1.75/100 = 0,75 mol
nY = nX – nH2 pư = 4 – 0,75 =3,25 mol
BTKL: mX = mY => nX.MX = nY.MY => 4.8,5 = 3,25.MY => MY = 136/13 => dY/H2 = 5,23.

Đáp án A
• Coi hhX ban đầu có x mol CH2=CH2 và y mol H2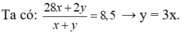
Coi hh ban đầu gồm 1 mol CH2=CH2 và 3 mol H2.
• hhY gồm 0,75 mol C2H6; (1 - 0,75) mol C2H4 và (3 - 0,75) mol H2
→ ∑nY = 0,75 + (1 - 0,75) + (3 - 0,75) = 3,25 mol.
Theo BTKL: mY = mX = 1 x 28 + 3 x 2 = 34 gam
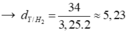

Đáp án D
hhX gồm H2 và C2H4 có dX/H2 = 7,5.
Dẫn X qua Ni, to → hhY có dY/H2 = 12,5.
• Đặt nH2 = x mol; nC2H4 = y mol.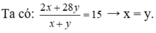
Đặt nH2 = 1 mol; nC2H4 = 1 mol.
Giả sử có x mol C2H6 tạo thành → hhY gồm C2H6 x mol; H2 (1 - x) mol và C2H4 (1 - x) mol.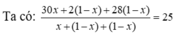
→ x = 0,8 → H = 80%

Đáp án C
Giả sử hỗn hợp X chứa 1 mol → nH2 = 0,8 mol, nC2H2 = 0,2 mol
Luôn có mX = mY → nY =
1
.
3
,
6
.
2
4
.
2
= 0,9 mol
Nhận thấy nH2 pu = nC2H4 pu = nX - nY = 1- 0,9 = 0,1 mol
→ H = 0 , 1 0 , 2 ×100% = 50%.

Đáp án D
hhX gồm H2 và C2H4 có dX/He = 3,75.
Dẫn X qua Ni, to → hhY có dY/He = 5.
• Đặt nH2 = x mol; nC2H4 = y mol.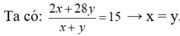
Đặt nH2 = 1 mol; nC2H4 = 1 mol.
Giả sử có x mol C2H6 tạo thành → hhY gồm C2H6 x mol; H2 (1 - x) mol và C2H4 (1 - x) mol.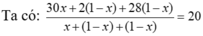
→ x = 0,5 → H = 50%

Giả sử nX =1
Có nH2 + nC2H4 = nX = 1
2nH2 + 28nC2H4 = mX = 3,75.4 = 15
⇒ nH2 = nC2H4 = 0,5
Đặt nC2H4 phản ứng = a ⇒ nH2 phản ứng = a.
⇒ nY = nX – nH2 phản ứng = 1 – a
MY = 5.4 =20
mY = mX =15 ⇒ nY = 15 : 20 =0,75 ⇒ a = 1- 0,75 = 0,25
⇒ H = 25%
Đáp án B.

Đáp án C
Hướng dẫn
Áp dụng sơ đồ đường chéo ta có :
n H 2 n C 2 H 4 = 28 - 15 15 - 2 = 1 1 Þ Có thể tính hiệu suất phản ứng theo H2 hoặc theo C2H4
Phương trình phản ứng :
H2 + C2H4 ![]() C2H6
C2H6
Áp dụng định luật bảo toàn khối lượng ta có :
mX = mY <=> nX. M - X = nY. M - Y <=> n X n Y = M - Y M _ X = 5 . 4 3 , 75 . 4 = 4 3
Chọn nX = 4 mol => n H 2 = n C 2 H 4 = 2 mol ; n H 2 ( p o ) . . = n X - n Y = 1 mol
=> Hiệu suất phản ứng : H = 1 2 .100% = 50%

Bài 16 :
Giả sử ban đầu có 1 mol X
Gọi số mol C2H4 và H2 là a và b
\(\left\{{}\begin{matrix}a+b=1\\\frac{28a+2b}{a+b}=4,25.2\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}a+b=1\\28a+2b=8,5\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}a=0,25\\b=0,75\end{matrix}\right.\)
\(PTHH:C_2H_4+H_2\rightarrow C_2H_6\)
Trước ___0,25___ 0,75_________
Phứng___a___________________
Tỉ lệ : \(n_{C2H4}< n_{H2}\)
Hiệu suất tính theo C2H4
Gọi số mol C2H4 phản ứng là a
\(\frac{a}{0,25}=75\%\)
\(\Rightarrow a=0,1875\)
\(PTHH:C_2H_4+O_2\rightarrow C_2H_6\)
Trước _0,25_____0,75____________
Phứng_0,1875___ 0,1875_________
Sau____0,0625___ 0,5625___0,1875
Sau phản ứng, số mol hỗn hợp:
\(n=0,0625+0,5625+0,1875=0,8125\)
Khối lượng hỗn hợp:msau = m trước = 8,5
\(M_Y=\frac{8,5}{0,8125}=\frac{136}{13}\)
Tỉ khối so với H2 \(=\frac{136}{13}:2=5,28\)
Bài 17 :
Gọi công thức anken là CnH2n
Giả sử ban đầu nCnH2n = nH2 = 1mol
Số mol hỗn hợp ban đầu là 1 + 1 = 2
Gọi số mol phản ứng là a mol
\(PTHH:C_nH_{2n}+H_2\rightarrow C_nH_{2n+2}\)
Trước _____1______1____________
Phứng _____a______ a
Sau ______1 - a ____ 1 - a_________ a
Số mol hỗn hợp sau phản ứng=1 - a + 1 - a + a = 2 - a
\(\frac{M_B}{M_A}=1,6\)
\(\Rightarrow\frac{m_B:n_B}{m_A:n_A}=1,6\)
Mà khối lượng sau phản ứng không thay đổi
Hay mB = mA
\(\Rightarrow\frac{n_A}{n_B}=1,6\)
\(\frac{2}{2-a}=1,6\)
\(\Rightarrow a=0,75\)
Hiệu suất phản ứng: \(H=\frac{a}{1}=\frac{0,75}{1}=75\%\)
Bài 18 :
\(M_X=9,25.2=18,5\)
\(n_X=\frac{22,4}{22,4}=1\left(mol\right)\)
\(m_X=18,5.1=18,5\left(g\right)\)
Theo bảo toàn khối lương:
mX = mY = 18,5
\(M_Y=10.2=20\)
\(\Rightarrow n_Y=\frac{18,5}{20}=0,925\)
Ta có: n khí giảm chính là nH2 phản ứng
\(\Rightarrow n_{H2_{pư}}=1-0,925=0,075\left(mol\right)\)
Đáp án C
Giả sử hỗn hợp đầu có 1 mol etilen và 3 mol H2. Hiệu suất tính theo etilen
nH2 pư = n etilen pư = 1.75/100 = 0,75 mol
nY = nX – nH2 pư = 4 – 0,75 =3,25 mol
BTKL: mX = mY => nX.MX = nY.MY => 4.8,5 = 3,25.MY => MY = 136/13 => dY/H2 = 5,23.