Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

gọi số mol O2 là x
ptpu
O2 + 2H2 --> 2H2O
x ----> 2x
=>3x = 75 - 30 = 45
=> x = 15
Vì khí còn lại cháy được nên là O2
=> VH2= 2x = 30 ml => %VH2 = 40%
=> VO2 = 45ml => %VO2 = 60%
Đổi 75 ml = 0,075 l
Vì khí còn lại cháy được là \(H20\) trong O
ð V = 30 ml = 0,03l
2 +
Pt 44,8 (l) 22,4 (l) 44,8 (l) (1)
Đb 0,03L 0,015 L 0,03L
Từ (1) => V= 0,03 +0,03 = 0,06 L => % V= 100% =80%
V = 0,015 L => %V = 100% = 20%
Cô mình sửa rồi nha

Chọn đáp án C
50 mL khí không bị ngưng tụ là C O 2 ; tỉ lệ n H 2 O : n C O 2 = 4 : 5
→ có 40 mL H 2 O
các khí và hơi đo ở cùng điều kiện nhiệt độ, áp suất → chọn điều kiện V = 10 mL ⇄ 1 mol.
Ta có: đốt 1 mol este X cần 5 m o l O 2 → t 0 5 m o l C O 2 + 4 m o l H 2 O
BTNT oxi có trong X: n O = 4
→ số O = 4 : 1 = 4.
Lại có số C = 5 : 1 = 5 và số H = 4 × 2 : 1 = 8
→ CTPT của X là C 5 H 8 O 4
Tính được MX = 132



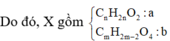
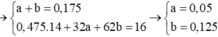
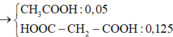

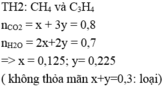
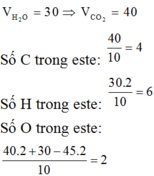

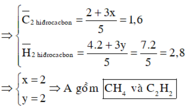
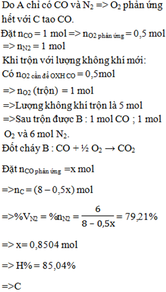

CxHy + (x + y/4)O2 ---> xCO2 + y/2H2O
x + y/4 = 2
x + y/2 = 1 + x + y/4
Thu được x = 1; y = 4
CH4.