Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


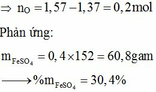

Đáp án : D
Cả quá trình : X -> hidroxit -> oxit Y -> Kim loại (Fe,Cu)
Có mS = 18g => nS = n S O 4 = 0,5625 mol
=> mKL = mX – m S O 4 = 26g

Đáp án D
Cả quá trình : X -> hidroxit -> oxit Y -> Kim loại (Fe,Cu)
Có mS = 18g => nS = nSO4 = 0,5625 mol
=> mKL = mX – mSO4 = 26g

Đáp án D
Cả quá trình: X → hidroxit → oxit Y → Kim loại (Fe,Cu)
Có mS = 18g => nS = nSO4 = 0,5625 mol
=> mKL = mX – mSO4 = 26g

Đáp án D
M g S O 4 : : a F e S O 4 : b → M g O : a F e 2 O 3 : 0 , 5 b → → T G K L 40 a + 8 b = 6 , 9 - 5 , 1 40 a + 80 b = 4 , 5 → a = b = 0 , 0375 → n C u S O 4 = 0 , 075 → x = 0 , 3

Gọi a, b là số mol Mg, Fe phản ứng.
Mg+CuSO4→MgSO4+Cu
a_____a_______a____a
Fe+CuSO4→FeSO4+Cu
b____b_______b_____b
(Nếu giải ra b>0 thì Fe đã phản ứng. Nếu giải ra b=0 thì Fe chưa phản ứng)
MgSO4+2NaOH→Mg(OH)2+Na2SO4
a________________a
FeSO4+2NaOH→Fe(OH)2+Na2SO4
b________________b
Mg(OH)2→MgO+H2O
a_________a
4Fe(OH)2+O2→2Fe2O3+4H2O
b______________b/2
5,1-24a-56b+64(a+b)=6,9
=> 5a+b=0,225
40a+160b/2=4,5
Giải hệ, được a=b=0,0375
%mMg=24.0,0375/5,1.100%=17,65%
%mFe=100%-17,65%=82,35%
Số mol Fe có trong A bằng(5,1-24.0,0375)/56=0,075(mol)
Fe dư và CuSO4 phản ứng hết.
nCuSO4=a+b=0,0375+0,0375=0,075(mol)
CM(CuSO4) =0,075/0,25=0,3(M) → Đáp án D
Cho 5,1 gam hỗn hợp gồm Mg và Fe vào 250 ml dung dịch CuSO4. Sau khi các phản ứng xảy ra hoàn toàn, lọc, thu được 6,9 gam chất rắn X và dung dịch Y chứa hai muối. Thêm dung dịch NaOH dư vào dung dịch Y. Lọc lấy kết tủa đem nung ngoài không khí đến khối lượng không đổi được 4,5 gam chất rắn Z.
a) Tính thành phần phần trăm theo khối lượng của Mg trong hỗn hợp ban đầu.
b) Tính nồng độ mol của dung dịch CuSO4.
c) Tính thể tích khí SO2 (đo ở đktc) thu được khi hoà tan hoàn toàn 6,9 gam chất rắn X trong dung dịch H2SO4 đặc, nóng.
cho mình hỏi câu này với ạ

Chọn đáp án A
mCu tối đa = 0,2´0,75´64 = 9,6 gam và mFe tối đa = 0,2´56 = 11,2 gam
Vì 9,6 + 11,2 > 14,08 Þ Fe2+ dư, Mg và Al bị oxi hóa hết Þ nFe trong Y = (14,08 – 9,6)/56 = 0,08
Đặt nMg = 4a Þ nAl = a; BTE Þ 2´4a + 3a = 0,2 + 0,15´2 + 0,08´2 Þ a = 0,06
Þ Trong X chứa 0,24 mol Mg2+ + 0,06 mol Al3+ + 0,12 mol Fe2+
Þ Chất rắn sau cùng gồm: 0,24 mol MgO và 0,06 mol Fe2O3
Vậy mChất rắn = 0,24´40 + 0,06´160 = 19,2 gam

Định hướng tư duy giải
Ta có:
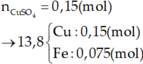
Dễ thấy 6 gam rắn là Fe2O3
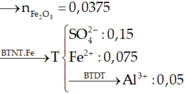
Có Al dư → Phần X phản ứng:
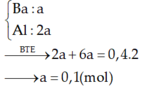
Chú ý: Vì chất tan thu được là Ba(AlO2)2→ tỷ lệ mol Ba : Al phải là 1 : 2