Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

C2H2 + 2AgNO3 + 2NH3 → C2Ag2 ↓ + 2NH4NO3
CH3CHO + 2AgNO3 + 3NH3 + H2O → CH3COONH4 + 2Ag ↓ + 2NH4NO3
C2Ag2 + 2HCl → 2AgCl ↓ + C2H2 ↑
Y(AgCl, Ag) + HNO3 --> ...
Ag + 2HNO3 → AgNO3 + NO2 ↑ + H2O

TL:
Glyxin: H2N-CH2-COOH (75 g/mol), axit cacboxylic: R(COOH)n.
Phần 1: Khi cho hh X phản ứng với NaOH thì muối thu được gồm: H2N-CH2-COONa và R(COONa)n.
Khí Y khi cho đi qua Ca(OH)2 dư thì CO2 và H2O bị hấp thụ còn N2 thoát ra ngoài. Do đó khối lượng tăng lên 20,54 g chính là khối lượng của hh CO2 và H2O.
Mặt khác: CO2 + Ca(OH)2 \(\rightarrow\) CaCO3 + H2O, số mol của CaCO3 là 0,34 mol = số mol của CO2.
Suy ra, khối lượng của H2O = 20,54 - 44.0,34 = 5,88 g.
Như vậy, có thể thấy trong 1/2 hh X gồm có các nguyên tố (C, H, O, và N). Theo định luật bảo toàn nguyên tố ta có:
số mol của C = n(CO2) + n(Na2CO3) = 0,34 + 0,1 = 0,44 mol.
số mol của H = 2n(H2O) + nNa = 2.5,58/18 + 2.0,1 = 0,82 mol.
số mol của O = 2nNa = 0,4 mol.
Phần 2: Khi cho phản ứng với HCl chỉ có glyxin tham gia phản ứng: H2N-CH2-COOH + HCl \(\rightarrow\) ClH3N-CH2-COOH. Số mol của glyxin = số mol của HCl = 0,04 mol.
Do đó, trong 1/2 hh X thì số mol của N = 0,04 mol.
Như vậy, khối lượng của 1/2 hh X = mC + mH + mO + mN = 12.0,44 + 0,82.1 + 16.0,4 + 0,04.14 = 13,06 gam.
Khối lượng của glyxin trong 1/2 hh X = 75.0,04 = 3 gam.
Phần trăm khối lượng của glyxin trong hh X = 3/13,06 x 100% = 22,97%. (đáp án D).

a) Ở nhiệt độ thường:
2KOH + Cl2 \(\rightarrow\) KCl + KClO + H2O
6KOH + 3I2 \(\rightarrow\) 5KI + KIO3 + 3H2O
(Trong môi trường kiềm tồn tại cân bằng : \(\text{3XO- ⇌X- + XO}_3^-\)
Ion ClO- phân hủy rất chậm ở nhiệt độ thường và phân hủy nhanh khi đun nóng, ion IO- phân hủy ở tất cả các nhiệt độ).
b) Các phương trình hóa học :
Ion ClO- có tính oxi hóa rất mạnh, thể hiện trong các phương trình hóa học:
- Khi cho dung dịch FeCl2 và HCl vào dung dịch A có khí vàng lục thoát ra và dung dịch từ không màu chuyển sang màu vàng nâu :
2FeCl2 + 2KClO + 4HCl \(\rightarrow\) 2FeCl3 + Cl2 + 2KCl + 2H2O
- Khi cho dung dịch Br2 vào dung dịch A, dung dịch brom mất màu :
Br2 + 5KClO + H2O \(\rightarrow\) 2HBrO3 + 5KCl
- Khi cho H2O2 vào dung dịch A, có khí không màu, không mùi thoát ra:
H2O2 + KClO \(\rightarrow\) H2O + O2 + KCl
- khi cho CO2 vào A
CO2 + KClO + H2O \(\rightarrow\) KHCO3 + HClO

Ta có mC = 0,75m (gam) > 0,7m (gam)
\(\Rightarrow\) trong C có Fe dư
\(\Rightarrow\) HNO3 hết, trong B chỉ chứa muối Fe(NO3)2
PT:
Fe + 4HNO3 \(\rightarrow\)Fe(NO3)3 + NO + 2H2O
Fe + 6HNO3 \(\rightarrow\) Fe(NO3)3 + 3NO2 + 3H2O
Fe + 2Fe(NO3)3 \(\rightarrow\) 3Fe(NO3)2
Ta có : \(n_{hh}=\frac{2,87.1,2}{0,082.\left(273+27\right)}=0,14mol\)
\(\Rightarrow\) số mol HNO3 tạo muối = 0,44 – 0,14 = 0,3 (mol)
\(\Rightarrow\) \(n_{Fe\left(NO_3\right)_2}=0,15mol\)
\(\Rightarrow\) Khối lượng muối trong B = 0,15.180 = 27 (gam)
\(\Rightarrow\) nFe (pu) = 0,15 (mol) => mFe(pu) = 0,15.56 = 8,4 (gam)
\(m=\frac{8,4.100}{25}=33,6\left(g\right)\)

Chọn C
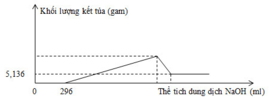
Vì: Quan sát đồ thị ta thấy:
mFe(OH)3 = 5,236 gam => nFe(OH)3 = 0,048 mol
nHNO3 dư = 0,296 mol => nHNO3 pư = 0,8 – 0,296 = 0,504 mol
Phần 1: Cho X tác dụng với H2SO4 đặc cũng như cho hỗn hợp đầu tác dụng
BT e: 3nAl = 2nSO2 => nAl = 2.0,09/3 = 0,06 mol
Phần 2: Cho X tác dụng với HNO3 cũng như cho hỗn hợp đầu tác dụng
Al + 4HNO3 → Al(NO3)3 + NO + 2H2O
0,06→0,24
Fe2O3 + 6HNO3 → 2Fe(NO3)3 + 3H2O
0,024←0,144←0,048
Fe2O3 + 6HNO3 → 2Fe(NO3)3 + 3H2O
0,02 ←0,504-0,24-0,144 = 0,12
mCr2O3 (1 phần) = 0,02.152 = 3,04 gam
=> mCr2O3 = 6,08 gam

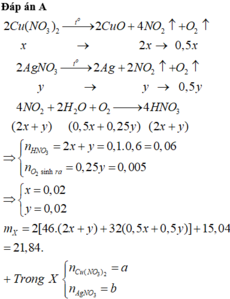

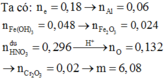
Đáp án A
P1: + NaOH → H2 → có Al dư → n A l = 2 3 n H 2 = 0 , 09 m o l
P2: Bảo toàn e: 2 n C u + n A g + 3 n A l = 3 n N O → 2 n C u + n A g = 0 , 021 m o l
Lại có: 64 n C u + 108 n A g + 27 n A l = 3 , 33 g → 64 n C u + 108 n A g = 0 , 9 g
→ n C u = 0 , 009 ; y = 0 , 003 m o l
Trong 6,66g B có: 0,018 mol Cu ; 0,006 mol Ag ; 0,18 mol Al
Dung dịch C + HCl không tạo kết tủa → không có Ag+
+) Dung dịch D + thanh Fe:
m g i ả m = m F e p ư - m C u r a = 56 ( n F e ( a x ) + n F e ( C u 2 + ) ) - 64 n C u 2 +
Lại có: n F e ( a x ) = n H 2 = 0 , 04 m o l → n C u 2 + = 0 , 012 m o l
Bảo toàn nguyên tố:
n A g 2 S O 4 = 1 / 2 n A g ( B ) = 0 , 003 m o l ; n C u S O 4 = n C u ( B ) + n C u ( C ) 2 + = 0 , 015 m o l
→ m A g 2 S O 4 ( X ) = 16 , 32 %