Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
· 1 2 X chứa 0,01 mol Cr2O3, 0,02 mol Al.
· Phần 1: + H2SO4 ® 0,04 mol SO2
Có 2 n SO 2 = 0 , 08 mol > 3 . n Al = 0 , 06 mol
Þ Chứng tỏ oxit sắt là FeO hoặc Fe3O4: n oxit Fe = 0 , 08 - 0 , 06 = 0 , 02 mol
· Phần 2: + vừa đủ 0,25 mol HCl ® 0,015 mol H2
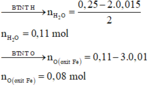
Þ Số nguyên tử O trong oxit Fe = 0 , 08 0 , 02 = 4
Þ Oxit sắt là Fe3O4.
· Sau phản ứng với NaOH dung dịch chứa: Na+ (x mol), Cl- (0,25 mol), AlO 2 - (0,02 mol), CrO 2 - (a mol).
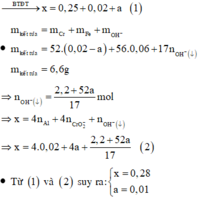

Đáp án C
Xét phần 1: quy Y về Fe, Cr, Al và O ![]()
-Xét phần 2: bảo toàn nguyên tố Hidro: ![]()
=> bảo toàn nguyên tố Oxi:
![]()
Quay lại phần 1, bảo toàn electron: ![]()
Xét phần 2: bảo toàn khối lượng: ![]()
Lại có: ![]() đều phản ứng với NaOH theo dạng:
đều phản ứng với NaOH theo dạng:
![]()
![]()
= (0,04 + 2a) mol
Bảo toàn nguyên tố Al và Cr: ![]()
Bảo toàn nguyên tố Natri: ![]()
Bảo toàn khối lượng:![]()
![]()
![]()
![]()
![]()

Đáp án C


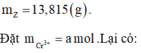
![]()
đều phản ứng với NaOH theo dạng:
![]()
![]()
Bảo toàn nguyên tố Al và Cr
![]()
Bảo toàn nguyên tố Natri: ![]()
Bảo toàn khối lượng:
13,815 + 40x (0,27 + a) = 6,6 + 0,25 × 58,5 + 0,02 × 82+ 107a + 18 × (0.04 + 2a)
=> a = 0,01 mol => x = 0,27 + 0,01 = 0,28 mol

Giải thích:
Phản ứng xảy ra hoàn toàn, chất rắn sau phản ứng + NaOH thu được khí H2 => chứng tỏ có Al dư sau phản ứng => phản ứng nhiệt nhôm oxit sắt hết. Chất rắn Y gồm có Al2O3, Fe và Al dư
Phần 2: nFe = 16,8 : 56 = 0,3 (mol) ;
Bảo toàn e => 3nAl dư = 2 nH2 => nAl = 2/3. nH2 = a (mol)
Phần 1: Nếu không tạo muối NH4NO3 thì ne ( Fe, Al dư) nhường = ne (NO nhận)
=> 0,3. 3 + 3a = 3a => vô lí
Vậy phải tạo muối NH4NO3
=> nNH4NO3 = ( 3nFe + 3nAl – 3nNO)/8 = ( 0,3. 3+ 3a – 3a) /8 = 0,1125 (mol)
mmuối = mFe(NO3)3 + mAl(no3)3 + mNH4NO3
=> mAl(NO3)3 = 233,7 – 0,3. 242 – 0,1125.80 = 152, 1(g)
nAl(NO3)3 ≈ 0,714 (mol)
Rắn Y phản ứng vừa đủ với dd NaOH
Al2O3 + 2NaOH → 2NaAlO2 + H2O
Al + NaOH → NaAlO2 + 3/2H2
=> nNaOH = nNaAlO2- = nAl(NO3)3 = 0,714 (mol) ( Bảo toàn nguyên tố Al)
=> VNaOH = 0,714: 2 = 0,357 (lít) = 357 (ml)
Gần nhất với 352 ml
Đáp án D

Đáp án B.
![]()
Giả sử Z + H2SO4 → dung dịch muối tạo thành chỉ có Fe2(SO4)3:
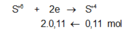
![]()
![]()
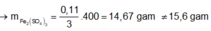
→ muối thu được gồm FeSO4 và Fe2(SO4)3.
Ta có sơ đồ phản ứng:
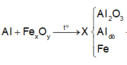
→ + N a O H d ư
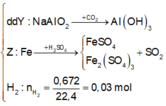

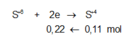
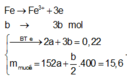
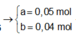
![]()
X tác dụng được với dung dịch NaOH tạo khí H2 →Al dư.
![]()
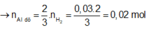
![]()
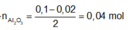
![]()
![]()
![]()
![]()

Coi hỗn hợp X ban đầu cũng như hỗn hợp Y gồm a mol Al và 3b mol Fe, 4b mol O.
Ở mỗi phần có nAl = 0,5a = nNaOH = 0,05 nên a = 0,1.
Áp dụng định luật bảo toàn mol electron cho phần 2 có:
hay 4,5b + 1,5a = 4b + 0,165 ⇒ b = 0,03.
Vậy m = mFe +mO + mAl = 9,66 (gam)
Đáp án C
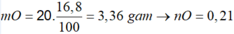
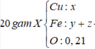
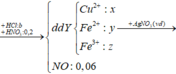
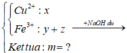
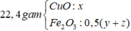
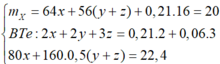
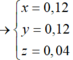
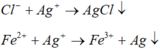
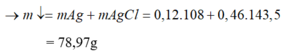

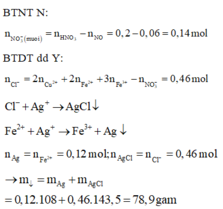
Đáp án cần chọn là: C