Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
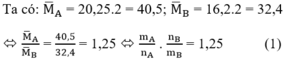
Áp dụng định luật bảo toàn khối lượng ta có: mA = mB
![]()
Giả sử ban đầu có 1 mol hỗn hợp A => nB = 1,25.1 = 1,25 mol
Trong phản ứng đề hidro hóa: số mol hỗn hợp khí sau phản ứng tăng, số mol tăng của hỗn hợp B so với hỗn hợp A chính là số mol các chất phản ứng.
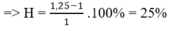

Hoàn toàn tương tự bài toán trước. Có thể tự chọn lượng chất rồi bảo toàn khối lượng cho phản ứng, hoặc một cách nhanh hơn là áp dụng công thức:

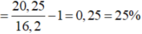
Vậy đáp án đúng là A

![]() Hỗn hợp anken hết trước, hiệu suất tính theo anken
Hỗn hợp anken hết trước, hiệu suất tính theo anken
Ta có: ![]() (vì n = pV/RT suy ra n tỉ lệ thuận với p)
(vì n = pV/RT suy ra n tỉ lệ thuận với p)
(trong đó n1, p1 là số mol và áp suất hỗn hợp lúc đầu, n2, p2 là số mol, áp suất hỗn hợp lúc sau)
![]()
Số mol hỗn hợp sau:
![]()
Số mol khí giảm
![]()
Vậy hiệu suất ![]()
Đáp án B.

Đây là một ví dụ rất đơn giản nhưng đặc trưng về quan hệ số mol trong phản ứng cộng hidro của hidrocacbon chưa no
Dễ tính đươc
![]()
Trong phản ứng hidro hóa hidrocacbon chưa no thì số mol khí giảm chính bằng số mol hidro phản ứng suy ra ![]()
Mặt khác đề cho hidrocacbon dư, phản ứng hoàn toàn nên
![]()
suy ra ![]()

Gọi nH2 = a mol ; nC3H6 = b mol
Coi nhh X = 1 mol ⇒ a +b = 1 (1)
Gọi Hiệu suất = a
\(M_X=\frac{2a+42a}{a+b}=\frac{2a+42a}{1}=11.2=22\left(2\right)\)
\(PTHH:C_3H_6+H_2\underrightarrow{^{xt,to}}C_3H_8\)
Ban đầu:___b__________a _____(mol)
Phản ứng:__b n__ bn ____bn____(mol)
Sau phản ứng_b-bn __a-bn ___ bn__(mol)
\(n_{hh\left(spu\right)}=n_{H2\left(dư\right)}+n_{C3H8}+n_{C3H6}=a-bn+bn+b-bn=a+b-bn\left(mol\right)\)
\(M_Y=\frac{m_{H2}+m_{C3H8}+m_{C3H6}}{n_{hh}}=\frac{2a+42bn+42a-42bn}{a+b-bn}=\frac{55}{3}.2=\frac{110}{3}\left(3\right)\)
\(\left(1\right)+\left(2\right)+\left(3\right)\Rightarrow\left\{{}\begin{matrix}a=0,5\\b=0,5\\n=8=80\%\end{matrix}\right.\)
Vậy hiệu suất là 80%

Đáp án D
Đề hiđro hóa hhM gồm C2H6 và C3H8 → hhN gồm 4 hiđrocacbon + H2
Gọi d là tỉ khối của M so với N.
• Giả sử số mol hỗn hợp đầu là 1 mol .
Khi tách hiđro có a mol etan phản ứng và b mol propan phản ứng (0 < a + b < 1)
→ Sau phản ứng: nN = nC2H6dư + nC3H8dư + nC2H4 + nC3H6 + nH2 = 1 + a + b (mol).
Theo BTKL: mM = mN
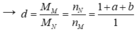 → 1 < d < 2
→ 1 < d < 2
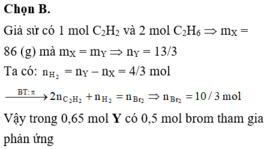
Đáp án : C
Áp dụng định luật bảo toàn khối lượng ta có: mA = mB
Giả sử ban đầu có 1 mol hỗn hợp A => nB = 1,25.1 = 1,25 mol
Trong phản ứng đề hidro hóa: số mol hỗn hợp sau phản ứng tăng, số mol tăng của hỗn hợp B so với hỗn hợp A chính là số mol các chất phản ứng
=> H = (1,25-1) .100% = 25%