Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đặt x và y là số mol O 3 và O 2 có trong 1 mol hỗn hợp khí
Hỗn hợp khí A : (48x + 32y)/(x+y) = 19,2 x 2 = 38,4
→ 3x = 2y → 40% O 3 và 60% O 2
Đặt x và y là số mol H 2 và CO có trong 1 mol hỗn hợp khí
Hỗn hợp khí B : (2x + 28y)/(x+y) = 3,6 x 2 = 7,2
→ x = 4y → 80% H 2 và 20% CO

a)ptpư : \(\text{FeS+2HCl→FeCl2+H2S}\)
\(x\) \(x\) (mol)
\(\text{ Fe+2HCl→FeCl2+H2}\)
\(y\) \(y\) (mol)
\(H2S+Pb\left(NO_3\right)_2\rightarrow2HNO_3+PbS\)
0,1mol \(n_{PbS}=\)\(\text{23,9/239=0,1mol}\)
\(\Rightarrow\) \(x\)\(\text{=0,1mol}\)
Mà : \(\text{x+y=4,48/22,4=0,2(mol)}\)
\(\Rightarrow\)\(\text{y=0,2−0,1=0,1(mol) }\)
Tự tính tỉ lệ nhé

Gọi số H2 và CO lần lượt là x; y
\(\rightarrow x+y=1\)
Ta có:
\(M_B=3,6M_{H2}=3,6.2=7,2\rightarrow m_B=2x+28y=7,2.1=7,2\)
Giải được: \(\left\{{}\begin{matrix}x=0,8\\y=0,2\end{matrix}\right.\)
Quy đổi A về dạng \(Oa\rightarrow M_{Oa}=19,2M_{H2}=19,2.2=38,4\)
\(\rightarrow16a=38,4\rightarrow a=2,4\)
\(H_2\rightarrow H_2O\)
\(CO\rightarrow CO_2\)
\(\rightarrow n_{O_{can}}=n_{H2}+n_{CO}=1\left(mol\right)\rightarrow n_A=\frac{1,2}{4}=0,4167\left(mol\right)\)

nBr2=0,05 mol
SO2 + Br2 + H2O =>H2SO4 +2HBr
0,05 mol<=0,05 mol
Chỉ có Cu pứ vs H2SO4 đặc nguội
Cu =>Cu+2 +2e
0,05 mol<= 0,1 mol
S+6 +2e =>S+4
0,1 mol<=0,05 mol
=>nCu=0,05 mol=>mCu=3,2g
=>mAl=5,9-3,2=2,7g
=>nAl=0,1 mol
Tổng nhh cr=0,1+0,05=0,15 mol

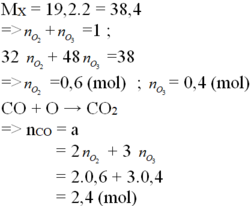
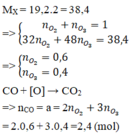
PTHH của các phản ứng :
2CO + O 2 → 2C O 2 (1)
3CO + O 3 → 3C O 2 (2)
Trong 1 mol hỗn hợp khí A có 0,6 mol O 3 và 0,4 mol O 2
Theo (1): 0,6 mol O 2 đốt cháy được 1,2 mol CO.
Theo (2) : 0,4 mol O 3 đốt cháy được 1,2 mol CO.
Kết luận : 1 mol hỗn hợp khí A đốt cháy được 2,4 mol khí CO.
Lấy số Mol của O2 và O3 ở đâu vậy bạn ?