Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Theo lí thuyết số mol hidro cần để phản ứng là
![]()
Suy ra hidro thiếu, hiệu suất tính theo hidro.
Khối lượng các chất trước phản ứng (cũng như sau phản ứng theo bảo toàn khối lượng):
m = 0,1.58 + 0,08.56 + 0,06.68 + 0,32.2 = 15 gam
![]()
Hiệu suất phản ứng ![]()
Đáp án A

Xét `a<b->H` tính theo `Fe.`
`Fe+S` $\xrightarrow{t^o}$ `FeS`
`0,5a->0,5a->0,5a(mol)`
Có `n_{Fe\ pu}=0,5a(mol)`
`Y` gồm `Fe:0,5a(mol);S:b-0,5a(mol);FeS:0,5a(mol)`
`FeS+2HCl->FeCl_2+H_2S`
`Fe+2HCl->FeCl_2+H_2`
Theo PT: `n_{H_2S}=n_{FeS}=0,5a(mol);n_{H_2}=n_{Fe}=0,5a(mol)`
`->{n_{H_2S}}/{n_{H_2}}={5.2-2}/{34-5.2}=1/3`
``->{0,5a}/{0,5a}=1/3` vô lí.
Xét `a>b->H` tính theo `S.`
`Fe+S` $\xrightarrow{t^o}$ `FeS`
`0,5b←0,5b->0,5b(mol)`
Có `n_{S\ pu}=0,5b(mol)`
`Y` gồm `Fe:a-0,5b(mol);S:0,5b(mol);FeS:0,5b(mol)`
`FeS+2HCl->FeCl_2+H_2S`
`Fe+2HCl->FeCl_2+H_2`
Theo PT: `n_{H_2S}=n_{FeS}=0,5b(mol);n_{H_2}=n_{Fe}=a-0,5b(mol)`
`->{n_{H_2S}}/{n_{H_2}}={5.2-2}/{34-5.2}=1/3`
``->{0,5b}/{a-0,5b}=1/3`
`->1,5b=a-0,5b`
`->a=2b`
`->a:b=2:1`

Đáp án B
Có npropenal = npropanal + npropan-1-ol + npropenal dư = 0,1 (mol)
⇒ n Y = 0 , 25 m o l ⇒ m X = m Y = 0 , 25 . 1 , 55 . 16 = 6 , 2 ( g ) V ậ y m H 2 t r o n g X = 6 , 2 - m p r o p e n a l = 0 , 6 ( g )
=>a = 0,3(mol)

Đáp án : D
Vì C4H4 và H2 có tỉ khối là 32 . Dựa vào sơ đồ đường chéo → C4H4 : H2 = 3:2
Goi số mol của C4H4 là 3x mol, số mol của H2 là 2x mol
Số mol H2 tham gia phản ứng là nH2 pư = nX - nY = 5x - 0,08
bảo toàn liên kết π nBr2 = 3nC4H4 - nH2 pư → 0,16 = 3. 3x - ( 5x- 0,08) → x = 0,02 mol
Khi đốt 0,06 mol C4H4 và 0,04 mol H2 sinh ra 0,24 mol CO2 và 0,16 mol H2O
Bảo toàn nguyên tố O → nO2 =
0
,
42
.
2
+
0
.
16
2
= 0,32 mol
Thể tích không khí cần dùng để đốt cháy hoàn toàn hỗn hợp Y là V = 0,32. 22,4. 5 = 35.84 lít. Đáp án D

Đáp án B
Theo bài: m X = 0,3.2 + 0,1.52 = 5,8 g
BTKL : mY = mX = 5,8g
Mặt khác:
![]()
Vậy số mol H2 phản ứng = 0,4 – 0,2 = 0,2 mol

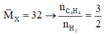
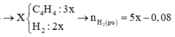
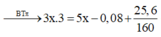
Hỗn hợp A ban đầu có SO2 : a mol, N2: 4a mol và O2: a mol.
Phản ứng:
2SO2 + O2< --> 2SO3 (XT: V2O5, t0) (1)
Gọi số mol SO2 phản ứng là x.
Theo (1): Số mol giảm = số mol O2 phản ứng = 0,5x mol
=> nB = 6a – 0,5x mol
Theo định luật bảo toàn khối lượng: mA = mB = m
\(d_{A/B}=\dfrac{m}{6a}:\dfrac{m}{6a-0,5x}=\dfrac{6a-0,5x}{6a}=0,93\)
\(\Rightarrow\dfrac{x}{a}=0,84\)
\(VậyH\%=84\%\)