Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
Al2O3 + 6HCl \(\rightarrow\) 2AlCl3 + 3H2O
Cu + HCl ( Khong pu)
\(\Rightarrow\) kim loai A la Cu
\(\Rightarrow n_{CuO}=\dfrac{2,75}{80}\approx0,03\left(mol\right)\)
2Cu + O2 \(\underrightarrow{t^0}\) 2CuO
de: 0,03 \(\leftarrow\) 0,03
\(m_{Cu}=1,92g\)
2Al + 6HCl \(\rightarrow\) 2AlCl3 + 3H2
de: 0,1 \(\leftarrow\) 0,15
\(m_{Al}=2,7g\)
\(m_{Al_2O_3}=10-2,7-1,92=5,38g\)
\(\%m_{Cu}=19,2\%\)
\(\%m_{Al}=27\text{%}\)
\(\%m_{Al_2O_3}=100-27-19,2=53,8\%\)

2Al+6HCl---->2AlCl3+3H2
Al2o3+6HCl--->2AlCl3+3H2O
Cu+HCl--> không p/u
2Cu + O2---->2CuO
ncuO=2,75/80=0.034375(mol)
Cứ 2 mol Cu---à 2 mol CuO
0.034375<------0.034375
mCu=0,034375.64=2,2(g)
--->%mCu=2,2.100/10=22%
nH2=3,36/22,4=0,15(mol)
cứ 2 mol Al----->3 mol H2
0.1<-----0.15
mAl :0,1.27=2.7(g)
--->%mAl=2,7.100/10=27%
---->%mAl2o3=100%-27%-22%=51%

m khí = 8,96:22,4=0,4 mol
gọi số mol của 3 chât rắn lần lượt x, y ,z
Ta chỉ có Al và Mg tác dụng được vs HCl sinh ra khí H2
2Al + 6HCl -> 2AlCl3 + 3H2
2........6............2................3
x.......3x.........x...................3/2x
Mg + 2HCl -> MgCl2 + H2
1..........2..........1.................1
y.........2y...........y................y
ta có hpt
27x + 24y + 2,75=10
3/2x + y =0,4
=> x=0,261.....y=0.0083
m Al = 0,261 . 27 = 7,047g
m Mg = 0,0083. 24 = 0,203g
% Al = 7,047 :10 .100% =70,47%
%Mg= 0,203:10.100% = 2,03%
%Cu= 2,75:10.100%=27,5%

Vì Cu không tác dụng với dung dịch HCl nên chất rắn A sau phản ứng thu được là Cu
Đổi : 3,36 dm3 = 3,36 ( l)
Theo giả thiết ta có : n\(_{H2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
PTHH :
\(\left(1\right)2Al+6HCl\rightarrow2AlCl3+3H2\uparrow\)
0,1 mol....................................0,15mol
\(\left(2\right)Al2O3+6HCl->2AlCl3+3H2O\)
\(\left(3\right)2Cu+O2-^{t0}->2CuO\)
Ta có :
\(\%mAl=\dfrac{0,1.27}{10}.100\%=27\%\)
\(\%mCu=\dfrac{2,75}{10}.100\%=27,5\%\)
%mAl2O3 = 100% - 27% - 27,5% = 45,5%

a) Do Cu không tác dụng với dd HCl nên được đem đi đốt trong không khí thu được CuO (Chất rắn Y)
nCuO=\(\dfrac{2,75}{80}=\text{0,034375}\) (mol)
2Cu + O2 -----to----> 2CuO
0,034375------------->0,034375(mol)
=> m Cu=0,034375.64 = 2,2(g)
=>mMg+Al =10 - 2,2 = 7,8(g)
Gọi a,b lần lượt là số mol của Mg,Al:
Mg+2HCl \(\rightarrow\) MgCl2+H2
a------2a------------------>a(mol)
2Al+6HCl \(\rightarrow\) 2AlCl3+3H2
b------3b----------------->1,5b(mol)
Ta có: \(\left\{{}\begin{matrix}a+1,5b=\dfrac{8,96}{22,4}\\24a+27b=7,8\end{matrix}\right.\)
=> a=0,1 , b=0,2
\(\%m_{Mg}=\dfrac{0,1.24}{10}.100=24\%\)
\(\%m_{Al}=\dfrac{0,2.27}{10}.100=54\%\)
\(\%m_{Cu}=\dfrac{2,2}{10}.100=22\%\)
b) \(n_{HCl}=2a+3b=2.0,1+3.0,2=0,8\left(mol\right)\)
\(\Rightarrow V_{HCl}=0,8.1=0,8\left(l\right)\)
c)\(n_{HCl}=0,8\left(mol\right)\Rightarrow n_{Cl^-}=0,8\left(mol\right)\)
\(m_{muói}=m_{kl}+m_{Cl^-}=7,8+0,8.35,5=36,2\left(g\right)\)

\(n_{CuO}=n_{Cu}=\dfrac{4}{80}=0,05mol\\ n_{H_2}=0,4mol\\ n_{Al}=a;n_{Zn}=b\\ 27a+65b=15,1-0,05\cdot64\\ BTe^-:3a+2b=2\cdot0,4\\ a=0,2;b=0,1\\ m_{ddHCl}=\dfrac{\left(0,6+0,2\right)\cdot36,5}{0,2}=146g\)



Qui đổi ½ hh B gồm Al (x mol), Fe (y mol), O (z mol)

=> mB = 2 (mAl + mFe + mO) = 102,78g
Gọi công thức của oxit sắt là FeaOb

=> Fe2O3

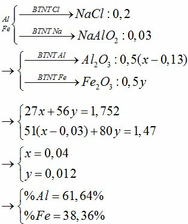
Bài trước mình bị nhầm
nH2 = \(\dfrac{3,36}{22,4}\) = 0,15 ( mol )
2Al + 6HCl \(\rightarrow\) 2AlCl3 + 3H2
0,1..........................................0,15
Al2O3 + 6HCl \(\rightarrow\) 2AlCl3 + 3H2O
=> mAl = 0,1 . 27 = 2,7 ( gam )
=> %mAl = \(\dfrac{27}{10}\times100=27\%\)
Ta có chất rắn A là Cu
=> nCuO = \(\dfrac{2,75}{80}\) = 0,034375 ( mol )
Cu + \(\dfrac{1}{2}\)O2 \(\rightarrow\) CuO
=> mCu = 0,034375 . 64 = 2,2 ( gam )
=> %mCu = \(\dfrac{2,2}{10}\times100=22\%\)
=> %mAl2O3 = 100 - 22 - 27 = 51%
Bạn ơi hình như đề nhầm 2,75 chứ không phải 2,79 nha
Ta có nH2 = \(\dfrac{3,36}{22,4}\) = 0,3 ( mol )
2Al + 6HCl \(\rightarrow\) 2AlCl3 + 3H2
0,2....................................0,3
Al2O3 + 6HCl \(\rightarrow\) 2AlCl3 + 3H2O
x................6x..........2x.............3x
Và chất rắn A là Cu
=> nCuO = \(\dfrac{2,75}{80}\) = 0,034375 ( mol )
Cu + \(\dfrac{1}{2}\)O2 \(\rightarrow\) CuO
=> mCu = 0,034375 . 64 = 2,2 ( gam )
=> %mCu = \(\dfrac{2,2}{10}\times100=22\%\)
=> mAl = 27 . 0,2 = 5,4 ( gam )
=> %mAl = \(\dfrac{5,4}{10}\times100=54\%\)
=> %mAl2O3 = 100 - 54 - 22 = 24 %