Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Bài 1 :
$n_{H_2} = 0,1(mol)$
Bảo toàn khối lượng :
$m_{H_2O} = 32 + 0,1.2 - 23,2 = 9(gam)$
$n_{H_2O} = 0,5(mol)$
X gồm $R$ và $R_2O$
$2R + 2H_2O \to 2ROH + H_2$
$R_2O + H_2O \to 2ROH$
Theo PTHH :
$n_R = 2n_{H_2} = 0,2(mol)$
$n_{H_2O} = n_R + n_{R_2O}$
$\Rightarrow n_{R_2O} = 0,3(mol)$
Ta có :
$0,2R + 0,3(2R + 16) = 23,2 \Rightarrow R = 23(Natri)$
Vậy X gồm $Na,Na_2O$
$n_{CO_2} = 0,2(mol) ; n_{NaOH} = \dfrac{6}{40} = 0,15(mol)$
Ta có :
$n_{NaOH} : n_{CO_2} = 0,15 : 0,2 = 0,75 < 1$.
Chứng tỏ sinh ra muối axit
$NaOH + CO_2 \to NaHCO_3$
$n_{NaHCO_3} = n_{NaOH} = 0,15(mol)$
$m_{muốI} = 0,15.84 = 12,6(gam)$
a, Gọi CTTQ của kim loại và oxit lần lượt là R và $R_2O$
Theo gt ta có: $n_{H_2}=0,1(mol)$
Bảo toàn e ta có: $n_{R}=0,2(mol)$
Bảo toàn khối lượng ta có: $n_{H_2O}=0,5(mol)$
$\Rightarrow n_{R_2O}=0,3(mol)$
Do đó ta có: \(0,2.R+0,3.\left(2R+16\right)=23,2\Rightarrow R=23\)
Vậy hỗn hợp X chứa Na và $Na_2O$
b, Ta có: $n_{NaOH}=0,15(mol);n_{CO_2}=0,2(mol)$
$NaOH+CO_2\rightarrow NaHCO_3$
Sau phản ứng dung dịch chứa 0,15 mol $NaHCO_3$
$\Rightarrow m_{muoi}=12,6(g)$

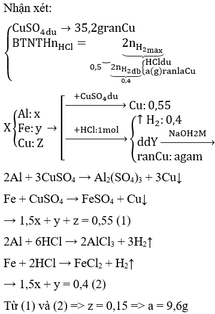
Có V1 < V2 => khi X tác dụng với H2O thì Al còn dư.
Giả sử số mol 3 kim loại là: x, y, z.
K + H2O → KOH + ½ H2↑
x → x 0,5x
Al + KOH + H2O → KAlO2 + 1,5H2↑
x ← x→ 1,5x
→ 0,5x + 1,5x = 0,2 → x = 0,1
X tác dụng với KOH: 0,1 . 0,5 + 1,5y = 0,35 => y = 0,2
Khi cho X tác dụng với H2O còn dư Al => Y chứa Al dư và Fe
nAl dư = nAl ban đầu – nAl phản ứng = 0,2 – 0,1 = 0,1mol
=> 0,1 . 1,5 + z = 0,4 => z = 0,25mol
=> m = 23,3g

\(n_{CaCO_3}=n_{MgCO_3}=a\left(mol\right)\\ CaCO_3-^{^{t^{^0}}}->CaO+CO_2\\ MgCO_3-^{^{t^{^0}}}->MgO+CO_2\\ CaO+H_2O->Ca\left(OH\right)_2\\ C:MgO\\ n_C=a=n_{MgCO_3}=\dfrac{20}{40}=0,5mol\\ x=0,5\left(100+84\right)=92\left(g\right)\\ V_{CO_2}=y=22,4.2a=22,4\left(L\right)\)

\(Bài.4:\\ 2Na+2H_2O\rightarrow2NaOH+H_2\\K_2O+H_2O\rightarrow2KOH\\ n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\Rightarrow n_{Na}=n_{NaOH}=2.0,1=0,2\left(mol\right)\\ m_{Na}=0,2.23=4,6\left(g\right)\\ \Rightarrow m_{K_2O}=9,3-4,6=4,7\left(g\right)\Rightarrow n_{K_2O}=\dfrac{4,7}{94}=0,05\left(mol\right)\\ n_{KOH}=0,05.2=0,1\left(mol\right)\\ m_{ddA}=m_X+m_{H_2O}-m_{H_2}=9,3+70,9-0,1.2=80\left(g\right)\\ C\%_{ddNaOH}=\dfrac{0,2.40}{80}.100=10\%\\ C\%_{ddKOH}=\dfrac{0,1.56}{80}.100=7\%\)
\(Bài.5\\R_2O+H_2O\rightarrow2ROH\\m_{ddROH}=23,5+176,5=200\left(g\right)\\ m_{ROH}=200.14\%=28\left(g\right)\\ Ta.có:28.\left(2M_R+16\right)=23,5.\left(2M_R+34\right)\\ \Leftrightarrow 9M_R=351\\ \Leftrightarrow M_R=39\left(\dfrac{g}{mol}\right)\\ \Rightarrow R\left(I\right):Kali\left(K=39\right)\\ \Rightarrow CTHH.oxit:K_2O\)