Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

PTHH:
\(Mg+H_2SO_4\rightarrow MgSO_4+H_2\)
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
Thí nghiệm 1:
Ta có:
\(n_{H_2SO_4}=n_{H_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
\(\Rightarrow C_{M\left(H_2SO_4\right)}=\dfrac{0,4}{2}=0,2M\)
\(n_{Mg}+n_{Zn}=n_{H_2SO_4}=0,4\left(mol\right)\left(1\right)\)
Lại có: \(24n_{Mg}+65n_{Zn}=24,3\left(2\right)\)
Giải hệ hai phương trình (1) và (2) ta được:
\(\left\{{}\begin{matrix}n_{Mg}=0,04\left(mol\right)\\n_{Zn}=0,36\left(mol\right)\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}m_{Mg}=0,96\left(g\right)\\n_{Zn}=23,4\left(g\right)\end{matrix}\right.\)
Thí nghiệm 2:
Ta có:
\(n_{H_2SO_4}=n_{H_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
\(\Rightarrow C_{M\left(H_2SO_4\right)}=\dfrac{0,5}{2}=0,25M\)
\(n_{Mg}+n_{Zn}=n_{H_2SO_4}=0,5\left(mol\right)\left(3\right)\)
Lại có: \(24n_{Mg}+65n_{Zn}=24,3\left(4\right)\)
Giải hệ hai phương trình (3) và (4) ta được:
\(\left\{{}\begin{matrix}n_{Mg}=0,2\left(mol\right)\\n_{Zn}=0,3\left(mol\right)\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}m_{Mg}=4,8\left(g\right)\\n_{Zn}=19,5\left(g\right)\end{matrix}\right.\)

Mg +H2SO4--->MgSO4 +H2
x x x x mol
Fe+ H2SO4---> FeSO4+ H2
y y y y mol
theo bài ta có : 24x+ 56y=1,36 và x+y=0,672/22,4
=> x=0,01 mol và y=0,02 mol
=> mMg=0,24 gam mFe=1,12 gam
tớ thấy đề bài khó để là ý b) bạn ạ nếu bạn xem lạ đề bài thì tốt quá![]()

a, Ta có: 27nAl + 56nFe = 22 (1)
PT: \(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
Theo PT: \(n_{H_2}=\dfrac{3}{2}n_{Al}+n_{Fe}=\dfrac{19,832}{24,79}=0,8\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}m_{Al}=0,4\left(mol\right)\\n_{Fe}=0,2\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Al}=\dfrac{0,4.27}{22}.100\%\approx49,09\%\\\%m_{Fe}\approx50,91\%\end{matrix}\right.\)
b, \(n_{HCl}=2n_{H_2}=1,6\left(mol\right)\)
\(\Rightarrow C_{M_{HCl}}=\dfrac{1,6}{0,5}=3,2\left(M\right)\)

\(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH:
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
0,2 0,2 0,2 0,2
\(a,\%m_{Fe}=\dfrac{0,2.56}{20}.100\%=56\%\)
\(\%m_{Cu}=100\%-56\%=44\%\)
\(b,C_{M\left(H_2SO_4\right)}=\dfrac{0,2}{0,1}=2\left(M\right)\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
\(1\) \(1\) \(1\)
\(0,2\) \(0,2\) \(0,2\)
\(n_{H_2}=\dfrac{V}{22,4}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
\(m_{Fe}=n.M=0,2.56=11,2\left(g\right)\)
\(^0/_0Fe=\dfrac{11,2}{20}.100^0/_0=56^0/_0\)
\(^0/_0Cu=100^0/_0-56^0/_0=44^0/_0\)
\(C_{M_{H_2SO_4}}=\dfrac{n}{V_{dd}}=\dfrac{0,2}{0,1}=2M\)

\(n_{H_2}=\dfrac{8,96}{22,4}=0,4(mol)\\ n_{Al}=x(mol);n_{Mg}=y(mol)\\ \Rightarrow 27x+24y=7,8(1)\\ a,2Al+6HCl\to 2AlCl_3+3H_2\\ Mg+2HCl\to MgCl_2+H_2\\ \Rightarrow 1,5x+y=0,4(2)\\ (1)(2)\Rightarrow x=0,2(mol);y=0,1(mol)\\ \Rightarrow \%_{Al}=\dfrac{0,2.27}{7,8}.100\%=69,23\%\\ \Rightarrow \%_{Mg}=100\%-69,23\%=30,77\%\)
\(b,\Sigma n_{HCl}=3x+2y=0,8(mol)\\ \Rightarrow C\%_{HCl}=\dfrac{0,8.36,5}{192,2}.100\%=15,19\%\\ c,n_{AlCl_3}=0,2(mol);n_{MgCl_2}=0,1(mol)\\ \Rightarrow C\%_{AlCl_3}=\dfrac{0,2.133,5}{0,2.27+192,2-0,3.2}.100\%=13,55\%\\ C\%_{MgCl_2}=\dfrac{0,1.95}{0,1.24+192,2-0,1.2}.100\%=4,89\%\)

a, Ta có: 27nAl + 56nFe = 27,8 (1)
PT: \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
Theo PT: \(n_{H_2}=\dfrac{3}{2}n_{Al}+n_{Fe}=\dfrac{17,353}{24,79}=0,7\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{Al}=0,2\left(mol\right)\\n_{Fe}=0,4\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Al}=\dfrac{0,2.27}{27,8}.100\%\approx19,42\%\\\%m_{Fe}\approx80,58\%\end{matrix}\right.\)
b, \(n_{H_2SO_4}=n_{H_2}=0,7\left(mol\right)\Rightarrow C_{M_{H_2SO_4}}=\dfrac{0,7}{0,5}=1,4\left(M\right)\)

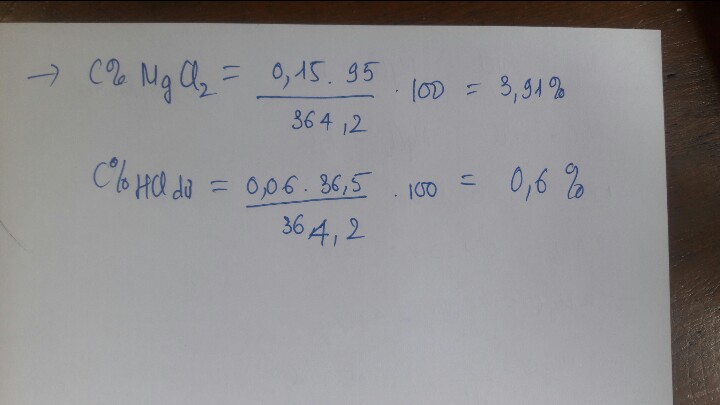
Mg + H2SO4 -> MgSO4 + H2 (1)
Zn + H2SO4 -> ZnSO4 + H2 (2)
a;
Trong các TH cùng một lượng A nhưng ở TH1 thì H2 sinh ra ít hơn ở TH2 nên ở TH1 thì kim loại tan chưa hết;ở TH2 axit dư
b;Ở TH1:kim loại dư
Theo PTHH 1và 2 ta có:
nH2SO4=nH2=0,8(mol)
CM dd H2SO4=\(\dfrac{0,8}{4}=0,2M\)
Ở TH2:axit dư
Đặt nMg=a
nZn=b
Ta có hệ:
\(\left\{{}\begin{matrix}24a+65b=48,6\\a+b=1\end{matrix}\right.\)
=>a=0,4;b=0,6
mMg=24.0,4=9,6(g)
mZn=65.0,6=39(g)