
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



tham khảo
Sơ đồ phân biệt sinh sản vô tính và sinh sản hữu tính:

- Nguyên tử N nằm ở ô số 7, nhóm VA => Có 5 electron ở lớp ngoài cùng, cần 3 electron để đạt cấu hình khí hiếm
- Nguyên tử C nằm ở ô số 6, nhóm IVA => Có 4 electron ở lớp ngoài cùng, cần 4 electron để đạt cấu hình khí hiếm
- Nguyên tử O nằm ở ô số 8, nhóm VIA => Có 6 electron ở lớp ngoài cùng, cần 2 electron để đạt cấu hình khí hiếm
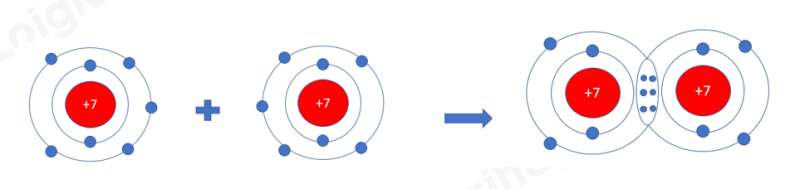
a) Xét phân tử Nitrogen: gồm 2 nguyên tử N
=> Liên kết cộng hóa trị, mỗi N góp 3 electron tạo thành 3 cặp electron dùng chung
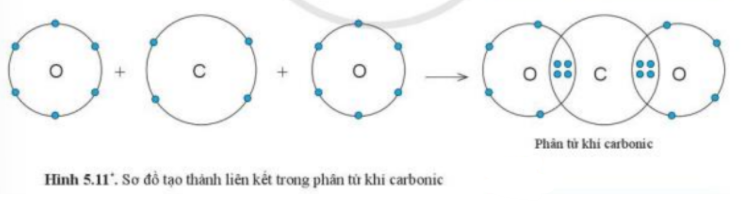
b) Xét phân tử Carbon dioxide: gồm 1 nguyên tử C và 2 nguyên tử O
=> Liên kết cộng hóa trị. Khi C kết hợp với O, nguyên tử C góp 4 electron, mỗi nguyên tử O góp 2 electron
=> Giữa nguyên tử C và nguyên tử O có 2 cặp electron dùng chung

Aluminium (Al) thuộc ô số 13, chu kì 3, nhóm IIIA trong bảng tuần hoàn.
Nguyên tử aluminium nhường 3 electron ở lớp ngoài cùng để trở thành ion aluminium, kí hiệu Al3+
Sơ đồ tạo thành ion aluminium:

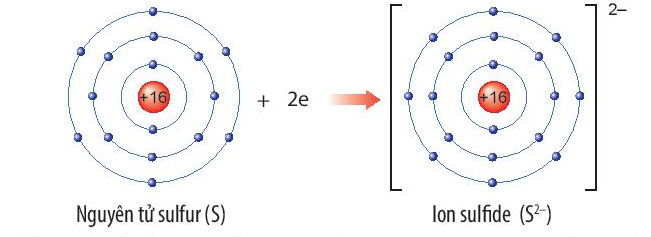
Nguyên tố sulfur (S) thuộc ô thứ 16, chu kì 3, nhóm VIA trong bảng tuần hoàn.
Nguyên tử sulfur nhận thêm 2 electron để trở thành ion ion sulfide (S2-). Ion sulfide (S2-) có 8 electron lớp ngoài cùng, sự phân bố electron trên ion sulfide (S2-) giống với sự phân bố electron của nguyên tử khí hiếm argon (Ar).

- Xét phân tử khí chlorine
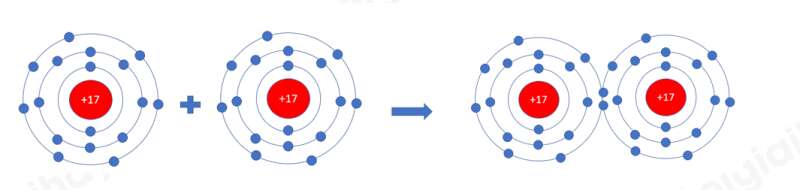
=> Mỗi nguyên tử Cl có 7 electron ở lớp ngoài cùng. Để có cấu trúc electron bền vững của khí hiếm Ar, khi hình thành phân tử chlorine, hai nguyên tử Cl đã liên kết với nhau bằng cách mỗi nguyên tử Cl góp chung 1 electron tạo thành 1 cặp electron dùng chung
- Xét phân tử khí amonia
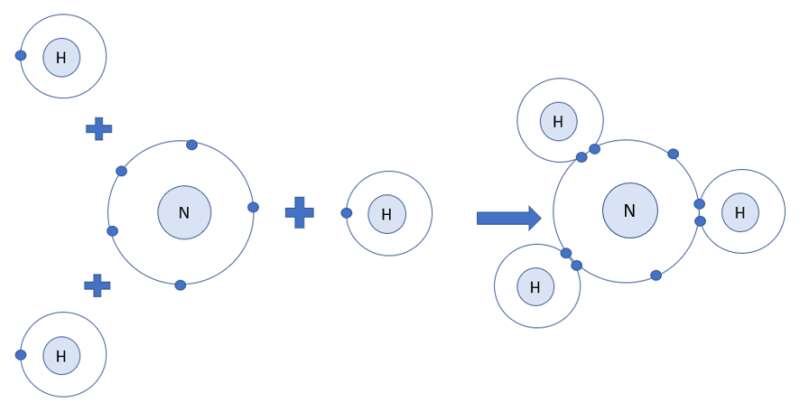
- Nguyên tử H có 1 electron ở lớp ngoài cùng
- Nguyên tử N có 5 electron ở lớp ngoài cùng
=> Nguyên tử H cần thêm 1 electron và N cần thêm 3 electron để đạt cấu hình electron bền vững của khí hiếm
=> Khi 3 nguyên tử H và 1 nguyên tử N liên kết với nhau, mỗi nguyên tử H góp 1 electron và nguyên tử N góp ra 3 electron để tạo ra 3 đôi electron dùng chung

Khi hình thành phân tử `MgO,` các nguyên tử đã có sự nhường nhận `e` như sau:
`-` Nguyên tử `Mg` nhường `2e` ở lớp ngoài cùng cho nguyên tử `O` để tạo thành ion dương \(Mg^{2+}\) có vỏ bền vững giống khí hiếm `Ne`.
`-` Nguyên tử `O` nhận `2e` vào lớp ngoài cùng từ nguyên tử `Mg` để tạo thành ion âm \(O^{2-}\) có vỏ bền vừng giống khí hiếm `Ne`.
Hai ion trái dấu hút nhau, hình thành nên liên kết ion trong phân tử `MgO`.

Nguyên tử `Cl` dùng chung `1` cặp electron với nguyên tử `H`
`->` Trong phân tử muối `HCl,` nguyên tử nguyên tố `Cl` sẽ có hóa trị là `I`.