
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


mH2O = 390 (g)
\(n_{CuSO_4.5H_2O}=\dfrac{x}{250}\left(mol\right)\)
=> \(n_{CuSO_4}=\dfrac{x}{250}\left(mol\right)\)
\(m_{CuSO_4}=\dfrac{x}{250}.160=0,64x\left(g\right)\)
mdd sau pư = x + 390 (g)
=> \(C\%=\dfrac{0,64x}{x+390}.100\%=7,27\%\)
=> x = 50 (g)

Ta có phương trình phản ứng hóa học sau 2K + 2H2O -----> 2KOH + H2
Số mol của K = 3,9/ 39 = 0,1
=> mol KOH = 0,1
=> mol H2O = 0,05
Theo cân bằng phương trình ta tính được:
mdd = mk + mH2O - mH2 = 3,9 + 36,2 - (0,05.2) = 40 gam
=> Áp dụng công thức C% = (mct/mdd).100%
ta có C% = [(0,1.56)/40].100% = 14%

nCuSO4.5H2O = \(\dfrac{25}{250}=0,1\left(mol\right)\)
nCuSO4 = nCuSO4.5H2O = 0,1 mol
nH2O = 5nCuSO4.5H2O = 0,1 . 5 = 0,5 mol
mCuSO4 = 0,1 . 160 = 16 (g)
mnước trong tinh thể = 0,5 . 18 = 9 (g)
mdd sau pứ = 25 + 9 + 375 = 409 (g)
C% dd CuSO4 = \(\dfrac{16}{409}.100\%=3,9\%\)

\(n_{CuSO_4}=\dfrac{50}{250}=0.2\left(mol\right)\)
\(n_{FeSO_4}=\dfrac{27.8}{278}=0.1\left(mol\right)\)
\(C_{M_{CuSO_4}}=C_{M_{FeSO_4}}=\dfrac{0.1}{0.1964}=0.5\left(M\right)\)
\(m_{dd_A}=50+27.8+196.4=274.2\left(g\right)\)
\(C\%_{CuSO_4}=\dfrac{0.1\cdot160}{274.2}\cdot100\%=6.47\%\)
\(C\%_{FeSO_4}=\dfrac{0.1\cdot152}{274.2}\cdot100\%=5.54\%\)
\(n_{CuSO_4.5H_2O}=\dfrac{50}{250}=0,2\left(mol\right)\)
=> \(m_{CuSO_4}=0,2.160=32\left(g\right)\)
\(m_{H_2O}=0,2.5.18=18\left(g\right)\)
\(n_{FeSO_4.7H_2O}=\dfrac{27,8}{278}=0,1\left(mol\right)\)=> \(m_{FeSO_4}=0,1.152=15,2\left(g\right)\)
\(m_{H_2O}=0,1.7.18=12,6\left(g\right)\)
\(m_{dd}=196,4+50+27,8=274,2\left(g\right)\)
\(V_{dd}=\dfrac{196,4+18+12,6}{1000}=0,227\left(l\right)\)
=> \(CM_{CuSO_4}=\dfrac{0,2}{0,227}=0,72M\)
\(C\%_{CuSO_4}=\dfrac{32}{274,2}.100=11,67\%\)
\(CM_{FeSO_4}=\dfrac{0,1}{0,227}=0,44M\)
\(C\%_{CuSO_4}=\dfrac{15,2}{274,2}.100=5,54\%\)

mCuSO4 trong tinh thể = \(\dfrac{160m}{250}\)= 0,64m
=> mH2O trong tinh thể = 0,36m
mH2O còn sau khi tách tinh thể = 152,25 - 0,36m
m CuSO4 trong dd bảo hoà = 35,5 - 0,64m = 0,207.(152,25 - 0,36m)
=> m =7,05(g)

\(mct_{CuSO_4}=\dfrac{600\times8}{100}=48g\)
\(n_{CuSO_4}=\dfrac{48}{160}=0.3mol=n_{CuSO_4.5H_2O}\)
\(m_{CuSO_4.5H_2O}=0.3\times250=75g\)

Gọi a là số mol CuSO4.5H2O cần thêm
Ta có
mCuSO4 ban đầu=500.8%=40g
mCuSO4 sau khi thêm vào=40+160a g
mdd CuSO4 sau khi thêm=500+250a
Ta có
\(\frac{40+160a}{500+250a}=15\%\)
\(\Rightarrow a=0,286\left(mol\right)\)
\(m_{CuSO4.5H2O}=0,286.250=71,5\left(g\right)\)

Gọi khối lượng của CuSO4.5H2O và dung dịch CuSO4 5% cần lấy là x, y ta có:
x + y=400 (1)
nCuSO4.5H2O = \(\dfrac{x}{250}\)
=> mCuSO4 (1) = \(\dfrac{16x}{25}\)
mCuSO4 (5%) = y.5% = 0,05y
mCuSO4 (10%) = 400.10% = 40
=> \(\dfrac{16x}{25}\) + 0,05y = 40 (2)
Từ (1) và (2) ta có hệ \(\left\{{}\begin{matrix}x+y=400\\\dfrac{16x}{25}+0,05y=40\end{matrix}\right.\)
<=> \(\left\{{}\begin{matrix}x=\dfrac{2000}{59}\\y=\dfrac{21600}{59}\end{matrix}\right.\)
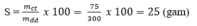
\(n_{CuSO_4.5H_2O}=\dfrac{25}{420}=0,06mol\)
\(m_{ddsau}=25+375=400g\)
Dung dịch thu được sau phản ứng là \(CuSO_4\)
\(C\%=\dfrac{0,06\cdot160}{400}\cdot100\%=2,4\%\)