Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(K_2O+H_2O\rightarrow2KOH\)
\(n_{K_2O}=\dfrac{47}{94}=0,5\left(mol\right)\)
\(\Rightarrow n_{KOH}=2.n_{K_2O}=1\left(mol\right)\)
\(\Rightarrow m_{KOH}=56\left(g\right)\)
\(C\%KOH=\dfrac{56}{47+106}.100\%\simeq36,6\%\)
Khối lượng K2O ban đầu: 47 gam.Khối lượng nước: 106 gam.Khối lượng KOH (Kali Hydroxide) = Khối lượng K2O (Kali Oxide).Tổng khối lượng dung dịch = Khối lượng K2O + Khối lượng nước = 47 gam + 106 gam = 153 gam.
Nồng độ phần trăm KOH = (Khối lượng KOH / Tổng khối lượng dung dịch) x 100 Nồng độ phần trăm KOH = (47 gam / 106 gam) x 100 ≈ 36.6%
Vậy nồng độ phần trăm của dung dịch KOH thu được là khoảng 36,6%.

Có V1 < V2 => khi X tác dụng với H2O thì Al còn dư.
Giả sử số mol 3 kim loại là: x, y, z.
K + H2O → KOH + ½ H2↑
x → x 0,5x
Al + KOH + H2O → KAlO2 + 1,5H2↑
x ← x→ 1,5x
→ 0,5x + 1,5x = 0,2 → x = 0,1
X tác dụng với KOH: 0,1 . 0,5 + 1,5y = 0,35 => y = 0,2
Khi cho X tác dụng với H2O còn dư Al => Y chứa Al dư và Fe
nAl dư = nAl ban đầu – nAl phản ứng = 0,2 – 0,1 = 0,1mol
=> 0,1 . 1,5 + z = 0,4 => z = 0,25mol
=> m = 23,3g


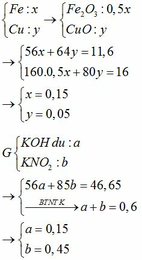
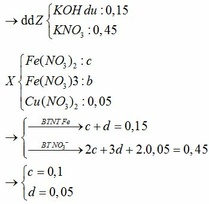

BTKL
mX + mdd HNO3 = mdd X + mH2O + m↑
=> mdd X = 11,6 + 87,5 – 30 . 0,1 – 46 . 0,15 = 89,2g
=> C%Fe(NO3)3 = 13,565%

\(m_{NaOH\left(A\right)}=20.5\%=1\left(g\right)\)
Trong B:
gọi x là khối lượng Na2O thêm vào , x>0 (g)
\(10\%=\dfrac{\dfrac{80}{62}x+1}{x+20}\)
\(\rightarrow x=0,84\left(g\right)\)
Vậy khối Na2O thêm vào dd A là 0,84 (g)
b, \(m_{KOH\left(A\right)}=2\%.20=0,4\left(g\right)\)
\(C\%_{KOH\left(B\right)}=\dfrac{0,4}{20+0,84}.100\%=1,92\%\)

a) Gọi hóa trị của kim loại cần tìm là n
A-----> A+n + ne
S+6 +2e -----> S+4
Áp dụng bảo toàn e : \(n_A=\dfrac{n_{SO_2}.2}{n}=\dfrac{0,6}{n}\)
Ta có: \(\dfrac{19,2}{A}=\dfrac{0,6}{n}\)
Chạy nghiệm theo n:
n=1 --------> A=32 (lọai)
n=2 -------> A=64 ( chọn - Cu)
n=3 ------->A=96 (loại)
Vậy kim loại A là Đồng (Cu)
b) Giả sử phản ứng tạo 2 muối
Gọi x, y lần lượt là số mol KHSO3 và K2SO3
=> \(\left\{{}\begin{matrix}x+y=0,3\\120x+158t=39,8\end{matrix}\right.\)
=> x=0,2, y=0,1 (thỏa mãn)
=> \(n_{KOH}=0,2+0,1.2=0,4\left(mol\right)\)
=> \(CM_{KOH}=\dfrac{0,4}{0,4}=1M\)

\(n_{KOH}=0,45.0,4=0,18\left(mol\right)\\n_{hhX}=\dfrac{15}{100}=0,15\left(mol\right)\Rightarrow n_{CO_2}=n_{hhX}=0,15\left(mol\right)\\ Vì:1< \dfrac{n_{KOH}}{n_{CO_2}}=\dfrac{0,18}{0,1}=1,8< 2\\ \Rightarrow dd.sau.phản.ứng:K_2CO_3,KHCO_3\\ Đặt:n_{K_2CO_3}=a\left(mol\right);n_{KHCO_3}=b\left(mol\right)\\ \Rightarrow\left\{{}\begin{matrix}a+b=0,1\\2a+b=0,18\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,08\\b=0,02\end{matrix}\right.\\ \Rightarrow C_{MddK_2CO_3}=\dfrac{0,08}{0,4}=0,2\left(M\right)\\ C_{MddKHCO_3}=\dfrac{0,02}{0,4}=0,05\left(M\right)\)

nHCl = 0,4.0,5 = 0,2 mol; nH2SO4 = 0,08.0,5 = 0,04 mol
nH+ = nHCl + 2nH2SO4 = 0,28 mol
Đặt số mol của Zn và Mg trong hỗn hợp ban đầu là x và y (mol)
Ta có: 65x + 24y = 5,34 (1)
Zn + 2H+ → Zn2+ + H2
x → 2x → x (mol)
Mg + 2H+ → Mg2+ + H2
y → 2y → y (mol)
Dung dịch Y gồm có:
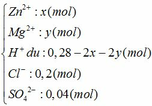
Ta thấy: nH+ + 2nZn2+ + 2nMg2+ (= 0,28 mol) < nNaOH (= 0,3 mol)
=> NaOH dư, Zn(OH)2 bị tan một phần
=> nNaOH hòa tan kết tủa = 0,3 – 0,28 = 0,02 mol
H+ + OH- → H2O
0,28-2x-2y → 0,28-2x-2y (mol)
Zn2+ + 2OH- → Zn(OH)2
x → 2x → x (mol)
Mg2+ + 2OH- → Mg(OH)2
y → 2y → y (mol)
Zn(OH)2 + 2OH- → ZnO22- + H2O
0,01 ← 0,02 (mol)
Khối lượng kết tủa thu được sau phản ứng: m kết tủa = mMg(OH)2 + mZn(OH)2
=> 99(x-0,01) + 58y = 8,43 <=> 99x + 58y = 9,42 (2)
Từ (1) và (2) ta có:

Ta có: nKOH : nBa(OH)2 = 0,4:0,05 = 8
Giả sử số mol của KOH và Ba(OH)2 lần lượt là 8a và a (mol)
=> nBa2+ = a (mol); nOH- = nKOH + 2nBa(OH)2 = 10a (mol)
- Khi kết tủa Mg(OH)2 và Zn(OH)2 đạt giá trị lớn nhất: nOH- = nH+ dư + 2nZn2+ + 2nMg2+
=> 10a = 0,04 + 2.0,06 + 2.0,06 => a = 0,028 mol
Ta thấy a < nSO42- => BaSO4 chưa đạt cực đại
- Giả sử sau khi Mg(OH)2 và Zn(OH)2 đạt cực đại ta thêm 8b mol KOH và b mol Ba(OH)2:
+ Lượng kết tủa sinh thêm là lượng BaSO4: nBaSO4 = nBa(OH)2 = b mol
=> mBaSO4 = 233b (gam)
+ Lượng kết tủa bị tan ra: nZn(OH)2 = nOH-: 2 = 10b : 2 = 5b (mol)
=> mZn(OH)2 = 99.5b = 495b (gam)
Ta thấy khối lượng kết tủa sinh ra nhỏ hơn khối lượng kết tủa bị tan nên khối lượng kết tủa lớn nhất là thời điểm Mg(OH)2 và Zn(OH)2 đạt cực đại. Khi đó: nBa(OH)2 = a = 0,028 mol
=> V = 0,028 : 0,05 = 0,56 (lít)
Kết tủa sau phản ứng gồm có:
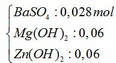
Mg(OH)2 → t ∘ MgO + H2O
0,06 mol → 0,06 mol
Zn(OH)2 → t ∘ ZnO + H2O
0,06 mol → 0,06 mol
=> m = mBaSO4 + mMgO + mZnO = 0,028.233 + 0,06.40 + 0,06.81 = 13,784 gam

a)
Mg + 2HCl --> MgCl2 + H2
Fe2O3 + 6HCl --> 2FeCl3 + 3H2O
MgCl2 + 2KOH + 2KCl + Mg(OH)2
FeCl3 + 3KOH --> 3KCl + Fe(OH)3
Mg(OH)2 --to--> MgO + H2O
2Fe(OH)3 --to--> Fe2O3 + 3H2O
b) Gọi số mol Mg, Fe2O3 là a, b (mol)
Theo PTHH: \(a=n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
Theo PTHH: \(n_{MgO}=n_{Mg}=a=0,15\left(mol\right)\)
=> \(n_{Fe_2O_3\left(chất.rắn.sau.khi.nung\right)}=\dfrac{22-0,15.40}{160}=0,1\left(mol\right)\)
Theo PTHH: \(n_{Fe_2O_3\left(bđ\right)}=n_{Fe_2O_3\left(chất.rắn.sau.khi.nung\right)}=0,1\left(mol\right)\)
=> b = 0,1 (mol)
\(\left\{{}\begin{matrix}\%m_{Mg}=\dfrac{0,15.24}{0,15.24+0,1.160}.100\%=18,37\%\\\%m_{Fe_2O_3}=\dfrac{0,1.160}{0,15.24+0,1.160}.100\%=81,63\%\end{matrix}\right.\)
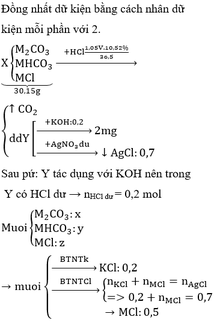
PTHH: \(K_2O+H_2O\rightarrow2KOH\)
Ta có: \(n_{K_2O}=\dfrac{x}{94}\left(mol\right)\) \(\Rightarrow n_{KOH\left(thêm\right)}=\dfrac{x}{47}\left(mol\right)\) \(\Rightarrow m_{KOH\left(thêm\right)}=\dfrac{56x}{47}\left(g\right)\)
Theo đề bài: \(\Sigma m_{KOH}=120\cdot51\%=61,2\left(g\right)\)
Ta lập được hệ phương trình: \(\left\{{}\begin{matrix}\dfrac{56x}{47}+12\%\cdot y=61,2\\x+y=120\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}x\approx43,68\\y\approx76,32\end{matrix}\right.\)
bạn xem lại số liệu nhé chứ số như kia xấu quá :((