Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Đặt
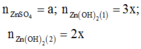
-Xét ở thí nghiệm 1
+ Nếu ![]() thì tạo thành kết tủa và kết tủa tan một phần
thì tạo thành kết tủa và kết tủa tan một phần
Và ở thí nghiệm 2 kết tủa cũng tan một phần
TN1: dung dịch sau phản ứng có ion:
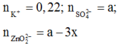
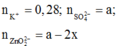
BTĐT:
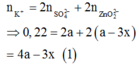
TN2: dung dịch sau phản ứng có ion:
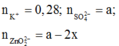
BTĐT:
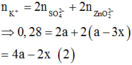
![]()
![]()
Với trường hợp ![]() thì không thỏa mãn
thì không thỏa mãn

Ta có :
\(H_2O\rightarrow OH^{ }+\dfrac{1}{2}H_2\)
Ta có :
$n_{OH^-} = 2n_{H_2} = 0,1(mol)$
Al3+ + 3OH- → Al(OH)3
0,03..........0,09.........0,03................(mol)
Al(OH)3 + OH- → AlO2- + 2H2O
0,01..........0,01...............................(mol)
$m_{Al(OH)_3} = (0,03 - 0,01).78 = 1,56(gam)$

(C6H10O5)n -> 2nCO2+2nC2H5OH
CO2+ Ca(OH)2-> CaCO3+H2O
0,55 0,55
2CO2 +Ca(OH)2->Ca(HCO3)2
0,2 0,1
Ca(HCO3)2-> CaCO3+ CO2+H2O
0,1 0,1
n(CO2)=0,55+0,2=0,75mol
Số mol tinh bột=0,75/2n =0,375/n
Vì hiệu suất 81% nên số mol tinh bột cần dùng là 0,375/n .100/81= 25/54n mol
Khối lượng tinh bột
m= 25/54n .162n=75g

nNaOH =0,3.1= 0,3 mol
CH3COOC6H5 + 2NaOH → CH3COONa + C6H5ONa + H2O
0,1 0,2 0,1 0,1
mrắn = mCH3COONa + mC6H5ONa + mNaOH dư
= 0,1.82 + 0,1.116 + 0,1.40 = 23,8g

2Al + 6hcl -> 2AlCl3 + 3H2 nHcl =0.3mol AlCl3 + 3 Naoh -> Al(oh)3 + 3Nacl
0.3 0.1 0.1 0.1 m = 0.1*78 = 7.8g
0,54