Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
Quy đổi hỗn hợp ban đầu: ta có:
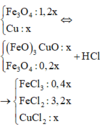
+ Thêm 0,08 mol MgCl2 ⇒ Ta có dung dịch Y gồm:
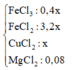
+ Sau khi điện phân đến khi anot có khí thoát ra ⇒ Có 3 kết tủa và 2 khí gồm:



Đáp án D
Hòa tan hỗn hợp rắn chứa l,2x mol Fe3O4 và x mol Cu xảy ra các phản ứng:
Do vậy sau phản ứng dung dịch X chứa 0,4x mol FeCl3, 3,2x mol FeCl2 và x mol CuCl2.
Cho thêm 0,08 mol MgCl2 vào X được dung dịch Y.
Điện phân Y đến khi xuất hiện H2O ở anot tức Cl- bị điện phân hết lúc này ở anot thu được 4,8x+0,08 mol Cl2 (bảo toàn C).
Lúc này ở catot thu được: 3,6x mol Fe, x mol Cu và H2 (do Mg2+ không bị điện phân).
Đồng thời quá trình điện phân nước có tạo ra OH- và làm kết tủa Mg2+.
Bảo toàn e: nH2= 0,08 mol
Vậy khối lượng dung dịch Y giảm chính là khối lượng của các chất thoát ra: (thoát ra thêm 0,08 mol Mg(OH)2).
71(4,8x+0,08)+0,08.2+3,6x.56+64x+0,08.58=71,12
Giải được x = 0,1.
Vậy cô cạn Y thu được 0,04 mol FeCl3, 0,32 mol FeCl2, 0,1 mol CuCl2 và 0,08 mol MgCl2.
Khối lượng muối khan thu được là 68,24 gam

MgCO3 + 2HCl → MgCl2 + CO2 + H2O (1)
BaCO3 + 2HCl → BaCl2 + CO2 + H2O (2)
CO2 + Ca(OH)2 → CaCO3↓ + H2O. (3)
Theo (1), (2) và (3), để lượng kết tủa B thu được là lớn nhất thì:
nCO2 = nMgCO3 + nBaCO3 = 0,2 mol
Ta có: 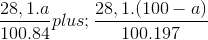 = 0,2
= 0,2
=> a = 29,89.

\(n_{Fe\left(NO_3\right)_3}=0,14mol\)
Đặt \(n_{Fe}=n_{FeO}=n_{Fe_2O_3}=n_{Fe_3O_4}=x\)
\(Fe\rightarrow Fe^{3+}\)
x x
\(FeO\rightarrow Fe^{3+}\)
x x
\(Fe_2O_3\rightarrow2Fe^{3+}\)
x 2x
\(Fe_3O_4\rightarrow3Fe^{3+}\)
x 3x
\(\Rightarrow7x=0,14\Rightarrow x=0,02\Rightarrow m=10,4g\)

C2H2 + 2AgNO3 + 2NH3 → C2Ag2 ↓ + 2NH4NO3
CH3CHO + 2AgNO3 + 3NH3 + H2O → CH3COONH4 + 2Ag ↓ + 2NH4NO3
C2Ag2 + 2HCl → 2AgCl ↓ + C2H2 ↑
Y(AgCl, Ag) + HNO3 --> ...
Ag + 2HNO3 → AgNO3 + NO2 ↑ + H2O


Chọn C
Fe3O4 + 8HCl → FeCl2 + 2FeCl3 + 4H2O
1,4x → 1,4x → 2,8x
Cu + 2FeCl3 → CuCl2 + 2FeCl2
x → 2x
Y gồm : 0,06 mol MgCl2 ; x mol CuCl2 ; 3,4x mol FeCl2 ; 0,8x mol FeCl3
Điện phân đến khi anot xuất hiện khí :
Catot : 0,06 mol Mg2+ ; x mol Cu2+ ; 3,4x mol Fe2+ ; 0,8x mol Fe3+
Anot : (0,12 + 11,2x) mol Cl-
(Mg2+ không bị điện phân)
Vậy Catot : 2H2O + 2e → H2 + 2OH-
Mol 0,12→ 0,06
mgiảm = mCu + mFe+ mH2 + mCl2
mmuối = mgiảm – mH2 + mMg (Vì bảo toàn e, số mol e H2 nhận đúng bằng số mol điện tích Mg2+ )
=> mmuối khan Y = 77,54 - 0,06.2 + 0,06.24 = 78,86g