Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

X + O2 → Y
Bảo toàn khối lượng có mO2 = 0,48 g → nO2 = 0,015 mol
Quy đổi Y thành kim loại và oxi
Ta có 4H+ + 4e + NO3- → 2H2O + NO
2H+ + O2- → H2O
→ nH+ = 4nNO + 2nO =4.0,03 + 2.0,03= 0,18 mol
Bảo toàn nguyên tố H thì nHNO3 = 0,18 mol
bài2
Ta có: nCO= 0,8 mol; nSO2= 0,9 mol
MxOy + yCO → xM + yCO2 (1)
Ta thấy đáp án M là Fe hoặc Cr nên M có số oxi hóa cao nhất là +3
2M + 6H2SO4 → M2(SO4)3+ 3SO2+ 6H2O (2)
Theo PT (2): nM= 2/3.nSO2= 0,6 mol
Theo PT (1):
x/y=nM/nCO=0,6/0,8=3/4 => Oxit là Fe3O4

HD:
Coi hh X chỉ gồm 2 nguyên tố là Fe (x mol) và O (y mol). Ta có: 56x + 16y = 3 (1).
Theo đề bài ta có:
Fe - 3e = Fe+3.
x 3x
O + 2e = O-2;
y 2y
N+5 +3e = N+2
0,075 0,025 mol
Như vậy ta có: 3x = 2y + 0,075 (2).
Giải hệ (1) và (2) thu được: x = 0,045; y = 0,03 mol.
Như vậy: m = 56.x = 2,52 g.
Gọi x,y lần lượt là số mol của Fe, O
Ta có: 56x + 16y = 3 (1)
Ta lại có: \(Fe^0\rightarrow Fe^{+3}+3e\)
O\(^0\)+2e\(\rightarrow\)O\(^{-2}\)
N\(^{+5}\) + 3e \(\rightarrow\) N\(^{+2}\)
Áp dụng định luật bảo toàn e:
=> 3x - 2y = 0.025x3 (2)
Giải hpt (1),(2) => x = 0.045 (mol); y = 0.03 (mol)
m\(_{Fe}\) = n.M = 0.045x56 = 2.52g

1,\(n_{hhB}=\frac{11,2}{22,4}=0,5\left(mol\right)\)
\(d_{\frac{hhB}{H_2}}=\frac{\overline{M}}{2}=8\Rightarrow\overline{M}=16\)
ta có sơ đồ dường chéo:
H 2 NO = 2 30 16 14 14
=>\(\frac{n_{H_2}}{n_{NO}}=1\Rightarrow n_{H_2}=n_{NO}=0,25\left(mol\right)\)
ta có các quá trình nhường nhận e:
\(Mg^0\rightarrow Mg^{+2}+2e\) \(Al^0\rightarrow Al^{+3}+3e\)
\(N^{+5}+3e\rightarrow N^{+2}\) \(2H^{+1}+2e\rightarrow H_2^0\)
0,25................0,25 0,25
mNO3=0,25.62=15,5(g)
mSO4=0,25.96=24(g)
=>mmuối=mkl+mNO3+mSO4=8,5+15,5+24=48(g)

công thức oxit của sắt : Fe2Oy
nSO2=0,075 mol
2FexOy + (6x-2y)H2SO4 ---> xFe2(SO4)3 + (3x-2y)SO2 + (6x-2y)H2O
0,25 mol..........................................0,075 mol
theo pt trên ta có
\(\frac{0,25.2}{6x-2y}=\frac{0,075.2}{3x-2y}\)
<=> 0,75x-0,5y=0,45x-0,15y
<=>0,3x=0,35y<=> \(\frac{x}{y}=\frac{0,35}{0,3}=\frac{7}{6}\)
=> oxit sắt là Fe7O6
sao bạn lại để đấp án oxit fe như vậy làm j có công thức oxit fe đó

nBr2=0,05 mol
SO2 + Br2 + H2O =>H2SO4 +2HBr
0,05 mol<=0,05 mol
Chỉ có Cu pứ vs H2SO4 đặc nguội
Cu =>Cu+2 +2e
0,05 mol<= 0,1 mol
S+6 +2e =>S+4
0,1 mol<=0,05 mol
=>nCu=0,05 mol=>mCu=3,2g
=>mAl=5,9-3,2=2,7g
=>nAl=0,1 mol
Tổng nhh cr=0,1+0,05=0,15 mol

Dung dịch X chứa hai muối sunfat là \(Fe_2\left(SO_4\right)_3\) và \(CuSO_4\)
\(FeS_2\rightarrow Fe^{3+}+2S^{+6}+15e\)
a -------> a -------2a------> 15a
\(Cu_2S\rightarrow2Cu^{2+}+S^{+6}+10e\)
0,06 ----->0,12--->0,06-> 0,6
Theo định luật bảo toàn điện tích:
\(3n_{Fe^{3+}}+2n_{Cu^{2+}}=2n_{SO_4^{2-}}\)
\(\Rightarrow3a+0,24=2.\left(2a+0,06\right)\)
\(\Rightarrow a=0,12\) mol


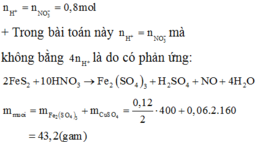
Đáp án A