Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

MgCO3 + 2HCl → MgCl2 + CO2 + H2O (1)
BaCO3 + 2HCl → BaCl2 + CO2 + H2O (2)
CO2 + Ca(OH)2 → CaCO3↓ + H2O. (3)
Theo (1), (2) và (3), để lượng kết tủa B thu được là lớn nhất thì:
nCO2 = nMgCO3 + nBaCO3 = 0,2 mol
Ta có: 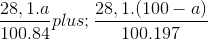 = 0,2
= 0,2
=> a = 29,89.

bạn có ghi bài trên lớp phần cấu tạo chất đủ không. co mình mượn chép lại mấy bài phần đó với

Bài giải:
- Vì =
=>
=
, suy ra polime đó là polietilen (-CH2 – CH2 - )n.
- Không thể là tinh bột (-C6H10O5-)n, vì có tỉ lệ =
, cũng không thể là PVC vì chất này khi cháy phải có sinh ra hợp chất chứa clo.

Các bạn chú ý, khi tính ra E(\(\pi\)) = 1,7085.10-18 thì đơn vị là J2s2/kg.m2 chứ không phải là đơn vị (J), sau đó nhân với NA và nhân với 10-3 thì mới ra được kết quả là 1,06.103 kJ/mol.
bạn có ghi bài trên lớp phần cấu tạo chất đủ không. co mình mượn chép lại mấy bài phần đó với


Chọn đáp án A
2H2SO4 + 2e → SO2 + SO42– + 2H2O ⇒ nSO42– = 1,2a mol
⇒ mmuối = mFe + mSO42– ⇒ 56a + 96 × 1,2a = 34,24 ⇒ a = 0,2 mol.