Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Dung dịch Ca(OH)2 không hấp thụ khí CO nên 6,72 lít khí thoát ra chính là khí CO dư.


nX = 0,075 mol. Giả sử số oxi hóa của S trong X là a
Bảo toàn e : 2.nA = (6 – a).0,075
Mà nA = 7,2/MA
=> MA = 192/(6 – a)
+) Nếu a = 4 (X là SO2) thì MA = 96g (không có kim loại thỏa mãn)
+) Nếu a = - 2 (X là H2S) thì MA = 24g (Mg)
Vậy A là Mg ; X là H2S

\(n_{H_2}=\dfrac{10,08}{22,4}=0,45\left(mol\right)\\ KL:A\left(x:hoa.tri.A\right)\\ 2A+xH_2SO_4\rightarrow A_2\left(SO_4\right)_x+xH_2\\ n_{Al}=\dfrac{2.0,45}{x}=\dfrac{0,9}{x}\left(mol\right)\\ M_A=\dfrac{8,1}{\dfrac{0,9}{x}}=9x\left(\dfrac{g}{mol}\right)\)
Xét: x=1;x=2;x=3;x=8/3 => Chọn x=3 thỏa, MA=27(g/mol)
=>A là nhôm (Al=27)

PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
Ta có: \(n_{H_2}=\dfrac{0,896}{22,4}=0,04\left(mol\right)\)
Theo PT: \(n_{Zn}=n_{H_2}=0,04\left(mol\right)\Rightarrow m_{Zn}=0,04.65=2,6\left(g\right)\)
⇒ mCu = 9 - 2,6 = 6,4 (g)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Zn}=\dfrac{2,6}{9}.100\%\approx28,89\%\\\%m_{Cu}\approx71,11\%\end{matrix}\right.\)

Câu 1
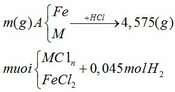
Áp dụng định luật bảo toàn nguyên
tố H ta có:
nHCl = 2nH2 = 2.0,045 = 0,09 mol
Áp dụng định luật bảo toàn khối lượng
ta có: mA + mHCl = m muối + mH2
=> m = m muối + mH2 – mA = 4,575 + 0,045.2 – 0,09.36,5 = 1,38 (gam)
Câu 2
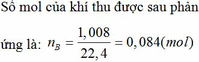
Do cho kim loại phản ứng với H2SO4 đặc và HNO3 đặc nên khí sinh ra là SO2 và NO2.
Áp dụng phương pháp đường chéo ta có:
SO2: 64 4,5
50,5
NO2: 46 13,5
→nSO2=nNO2=4,513,5=13
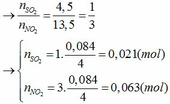
Đặt số mol của Fe và M lần lượt là x và y (mol)
- Khi cho hỗn hợp tác dụng với HCl:
Fe + 2HCl → FeCl2 + H2
x x (mol)
M + nHCl → MCln + 0,5nH2
y 0,5ny (mol)
nH2 = 0,045 => x + 0,5ny = 0,045 (1)
- Khi cho hỗn hợp tác dụng với HNO3 đặc và H2SO4 đặc:
Ta có các bán phản ứng oxi hóa – khử:
Fe → Fe3+ + 3e
x 3x
M → Mn+ + ne
y ny
S+6 + 2e → S+4 (SO2)
0,021 0,042
N+5 + 1e → N+4 (NO2)
0,063 0,063
Áp dụng định luật bảo toàn electron ta có: 3x + ny = 0,042 + 0,063 hay 3x + ny = 0,105 (2)
Từ (1) và (2) ta có hệ phương trình sau:
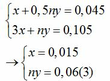
Mặt khác: mA = mFe + mM => 1,38 = 0,015.56 + My => My = 0,54(4)
Từ (3) và (4) suy ra M = 9n
Ta có bảng sau:
| n |
1 |
2 |
3 |
| M |
9 (loại) |
18 (loại) |
27 (nhận) |
Vậy kim loại M là nhôm, kí hiệu là Al.

\(A/PTHH:Fe+2HCl\rightarrow FeCl_2+H_2\\ Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(B/n_{H_2}=\dfrac{6,72}{22,4}=0,3mol\\ n_{Fe}=a;n_{Zn}=b\\ \Rightarrow\left\{{}\begin{matrix}56a+65b=18,6\\a+b=0,3\end{matrix}\right.\\ \Rightarrow a=0,1;b=0,2\\ m_{Fe}=0,1.56=5,6g\\ m_{Zn}=18,6-5,6=13g\)
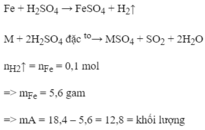

MA = 32.2 = 64(g/mol) ⇒ A là SO2
nSO2 = 0,15(mol)
Gọi n là hóa trị của kim loại R
Bảo toàn electron , ta có : n.nR = 2nSO2 = 0,3
⇒ nR = \(\dfrac{0,3}{n}\) mol
⇒ R = \(\dfrac{9,6}{\dfrac{0,3}{n}} = 32n\)
Với n = 2 thì R = 64(Cu)
Vậy kim loại R là Cu