Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Câu 1 :
a) \(CuO+2HCl\rightarrow CuCl_2+H_2O\left(1\right)\)
\(ZnO+2HCl\rightarrow ZnCl_2+H_2O\left(2\right)\)
b) Gọi số mol CuO, ZnO lần lượt là x, y
\(m_{hh}=m_{CuO}+m_{ZnO}\rightarrow80x+81y=12,1\left(+\right)\)
\(n_{HCl}=0,1.3=0,3\left(mol\right)\)
Theo (1): nHCl (1) = 2nCuO = 2x
Theo (2): nHCl (2) = 2nZnO = 2y
\(n_{HCl}=2x+2y=0,3\left(++\right)\)
Từ (+) và (++) \(\rightarrow\left\{{}\begin{matrix}x=0,05\\y=0,1\end{matrix}\right.\)
\(\%m_{CuO}=\frac{0,05.80}{12,1}.100\%=33,06\%\)
\(\%m_{ZnO}=100\%-33,06\%=66,94\%\)
c) \(CuO+H_2SO_4\rightarrow CuSO_4+H_2O\)
0,05_____0,05____________________
\(ZnO+H_2SO_4\rightarrow ZnSO_4+H_2O\)
0,1______0,1______________________
\(n_{H2SO4}=0,05+0,1=0,15\left(mol\right)\)
\(m_{H2SO4}=0,15.98=14,7\left(g\right)\)
\(m_{dd_{H2SO4}}=\frac{14,7}{20\%}=73,5\left(g\right)\)
Câu 2:
a) Gọi số mol Al, Fe là x, y
mhh = mAl + mFe
\(\rightarrow27x+56y=5,5\left(1\right)\)
\(n_{H2}=\frac{4,48}{22,4}=0,2\left(mol\right)\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\uparrow\)
x_____3x______x________3x/2
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
y____2y_______y________y
\(n_{H2}=\frac{3x}{2}+y=0,2\left(1\right)\)
Từ (1) và (2) \(\rightarrow\left\{{}\begin{matrix}x=0,1\\y=0,05\end{matrix}\right.\)
\(\%m_{Al}=\frac{0,1.27}{5,5}.100\%=49,09\%\)
\(\%m_{Fe}=100\%-49,09\%=50,91\%\)
b) \(n_{HCl_{pu}}=3.0,1+2.0,05=0,4\left(mol\right)\)
\(m_{HCl}=0,4.36,5=14,6\left(g\right)\)
\(m_{dd_{HCl}}=14,6:14,6\%=100\%\)
mdd sau phản ứng = mKL + mdd HCl - mH2
\(=5,5+100-0,2.2=105,1\left(g\right)\)
Sau phản ứng dung dịch có: AlCl3 (0,1 mol); FeCl2 (0,05 mol)
\(C\%_{AlCl3}=\frac{0,1.133,5}{105,1}.100\%=12,7\%\)
\(C\%_{FeCl2}=\frac{0,05.127}{105,1}.100\%=6,04\%\)

\(n_{H_2}=\dfrac{4.48}{22.4}=0.2\left(mol\right)\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(0.2.........0.4.........0.2......0.2\)
\(m_{Zn}=0.2\cdot65=13\left(g\right)\Rightarrow m_{ZnO}=14.6-13=1.6\left(g\right)\)
\(\%Zn=\dfrac{13}{14.6}\cdot100\%=89.04\%\)
\(\%ZnO=100\%-89.04\%=10.96\%\)
\(n_{ZnO}=\dfrac{1.6}{81}\approx0.02\left(mol\right)\)
\(ZnO+2HCl\rightarrow ZnCl_2+H_2O\)
\(0.02........0.04........0.02........0.02\)
\(n_{HCl}=0.4+0.04=0.44\left(mol\right)\)
\(C_{M_{HCl}}=\dfrac{0.44}{0.8}=0.55\left(M\right)\)
Eeeee ngồi tính sang chấn thật nó ra số xấu lần mò hơn 20p chưa biết tính sai chỗ nào

a, \(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(m_{HCl}=730.10\%=73\left(g\right)\Rightarrow n_{HCl}=\dfrac{73}{36,5}=2\left(mol\right)\)
\(n_{H_2}=\dfrac{17,92}{22,4}=0,8\left(mol\right)\)
→ nHCl > 2nH2 ⇒ HCl dư.
Ta có: 27nAl + 65nZn = 23,8 (1)
Theo PT: \(n_{H_2}=\dfrac{3}{2}n_{Al}+n_{Zn}=0,8\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{Al}=0,4\left(mol\right)\\n_{Zn}=0,2\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Al}=\dfrac{0,4.27}{23,8}.100\%\approx45,4\%\\\%m_{Zn}\approx54,6\%\end{matrix}\right.\)
b, Theo PT: \(\left\{{}\begin{matrix}n_{AlCl_3}=n_{Al}=0,4\left(mol\right)\\n_{ZnCl_2}=n_{Zn}=0,2\left(mol\right)\\n_{HCl\left(pư\right)}=2n_{H_2}=1,6\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow n_{HCl\left(dư\right)}=2-1,6=0,4\left(mol\right)\)
Ta có: m dd sau pư = 23,8 + 730 - 0,8.2 = 752,2 (g)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{AlCl_3}=\dfrac{0,4.133,5}{752,2}.100\%\approx7,1\%\\C\%_{ZnCl_2}=\dfrac{0,2.136}{752,2}.100\%\approx3,62\%\\C\%_{HCl}=\dfrac{0,4.36,5}{752,2}.100\%\approx1,94\%\end{matrix}\right.\)

a) \(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(n_{H_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
Gọi \(\left\{{}\begin{matrix}n_{Al}:x\left(mol\right)\\n_{Fe}:y\left(mol\right)\end{matrix}\right.\)
Ta có : \(\left\{{}\begin{matrix}27x+56y=11\\1,5x+y=0,4\end{matrix}\right.\)
=> x=0,2 ; y=0,1
\(\%m_{Al}=\dfrac{0,2.27}{11}.100==49,09\%\)
\(\%m_{Fe}=50,91\%\)
b) \(\Sigma n_{HCl}=3x+2y=0,8\left(mol\right)\)
=> \(V_{HCl}=\dfrac{0,8}{2}=0,4\left(lít\right)\)
c) \(CM_{AlCl_3}=\dfrac{0,2}{0,4}=0,5M\)
\(CM_{FeCl_2}=\dfrac{0,1}{0,4}=0,25M\)

Tham khảo
Gọi số mol của Fe và Al trong hỗn hợp lần lượt là x và y (x,y∈N*)(x,y∈N*)
Số mol H2 thu được là: nH2=8,9622,4=0,4(mol)nH2=8,9622,4=0,4(mol)
PTHH:
Fe+2HCl→FeCl2+H2↑(1)2Al+3HCl→2AlCl3+3H2(2)Fe+2HCl→FeCl2+H2↑(1)2Al+3HCl→2AlCl3+3H2(2)
Theo PTHH (1): nFe=x⇒nH2=xnFe=x⇒nH2=x
Theo PTHH (2): nAl=y⇒nH2=32ynAl=y⇒nH2=32y
Từ các PTHH và đề bài ta có:
(I)⎧⎨⎩x+32y=0,456x+27y=11(I){x+32y=0,456x+27y=11
Giải hệ phương trình I ta được x = 0,1 ; y = 0,2
Khối lượng của Fe và Al trong hỗn hợp là:
mFe=0,1.56=5,6(g)mAl=0,2.27=5,4(g)mFe=0,1.56=5,6(g)mAl=0,2.27=5,4(g)
Thành phần phần trăm khối lượng Fe và Al trong hỗn hợp là:
%mFe=5,611⋅100≈50,91%%mAl=100%−50,91%=49,09%%mFe=5,611⋅100≈50,91%%mAl=100%−50,91%=49,09%
b) Từ PTHH (1) ta có: nHCl(1)=2x=0,2(mol)nHCl(1)=2x=0,2(mol)
Từ PTHH (2) ta có: nHCl(2)=3y=0,6(mol)nHCl(2)=3y=0,6(mol)
Tổng số mol HCl tham gia phản ứng với hỗn hợp là:
nHCl=0,2+0,6=0,8(mol)nHCl=0,2+0,6=0,8(mol)
Thể tích dung dịch HCl 2M cần dùng:
VHCl(2M)=0,82=0,4(l)VHCl(2M)=0,82=0,4(l)
c) 0,4l = 400ml
Khối lượng dung dịch HCl 2M cần dùng là:
mHCl(2M)=VHCl(2M).DHCl(2M)=400.1,12=448(g)mHCl(2M)=VHCl(2M).DHCl(2M)=400.1,12=448(g)
Dung dịch thu được sau phản ứng có chứa muối FeCl2 và AlCl3
Khối lượng của dung dịch sau phản ứng là:
mdd=mhh+mHCl−mH2=11+488−0,8=458,2(g)mdd=mhh+mHCl−mH2=11+488−0,8=458,2(g)
theo PTHH nFeCl2=nFe=0,1(mol)nAlCl3=nAl=0,2(mol)nFeCl2=nFe=0,1(mol)nAlCl3=nAl=0,2(mol)
Khối lượng FeCl2 và AlCl3 thu được là:
mFeCl2=0,1.127=12,7(g)mAlCl3=0,2.133,5=26,7(g)mFeCl2=0,1.127=12,7(g)mAlCl3=0,2.133,5=26,7(g)
Nồng độ phần trăm các dung dịch thu được là:
C%FeCl2=12,7458,2⋅100≈2,77%

gọi x,y lần lượt là số mol của Al và Fe
PTHH 2Al + 6HCl ---> 2AlCl3 + 3H2
x 3x x 1,5x ( mol)
Fe + 2HCl ----> FeCl2 + H2
y 2y y y (mol)
ta có hệ PT : \(\left\{{}\begin{matrix}27x+56y=5,5\\1,5x+y=\dfrac{4,48}{22,4}=0,2\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,1\left(mol\right)\\y=0,05\left(mol\right)\end{matrix}\right.\)
=> mAl = n . M = 0,1 . 27 = 2,7 (g)
=> mFe = n . M = 0,05 . 56 =2,8
=> \(\%m_{Al}=\dfrac{2,7}{5,5}\cdot100=49,09\%\)
\(\rightarrow\%m_{Fe}=100-49,09=50,91\%\)
b) ta có : \(\sum n_{HCl}=3x+2y=0,4\left(mol\right)\Rightarrow m_{HCl}=0,4\cdot36,5=14,6\left(g\right)\)
\(\Rightarrow mdd_{HCl}=\dfrac{14,6\cdot100}{14,6}=100\left(g\right)\)
mddsau phản ứng = mAl+Fe + mddHCl - mH2
= 2,8 +2,7 + 100 - 0,2 . 2
= 105,1 (g)
\(m_{AlCl_3}=n\cdot M=0,1\cdot133,5=13,35\Rightarrow C\%=\dfrac{13,15}{105,1}\cdot100\%=12,7\%\)
\(m_{FeCl_2}=n.M=0,05\cdot127=6,35\Rightarrow C\%=\dfrac{6,35}{105,1}\cdot100=6,04\%\)
n H2 = 0,2 mol.
2Al + 6HCl -> 2AlCl3 + 3H2
a -> ....3a...........a........1,5a (mol)
Fe + 2HCl -> FeCl2 + H2
b -> ...2b..........b.........b (mol)
Theo đề bài, ta có hpt:
27a + 56b = 5,5
1,5a + b = 0,2
Giải hệ, được: a = 0,1; b = 0,05.
a/ m Al = 27a = 2,7g.
=> %Al = 49,09 %.
=> % Fe = 50,91 %. .
b/ m AlCl3 = 13,35g.
m FeCl2 = 6,35g.
Áp dụng đ. luật bảo toàn khối lượng:
mdd sau = mdd trước - m khí
.............= mdd HCl - m H2
.............= 100 - 2.0,2
.............= 99,6g
=> C% AlCl3 = 13,4 %.
.....C% FeCl2 = 6,38 %.

PTHH :
\(Al+3HCl\rightarrow AlCl_3+1,5H_2\uparrow\)
x 3x
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
x 2x
Gọi số mol của Al là x => \(m_{Al}=27x\)
Gọi số mol của Fe là y => \(m_{Fe}=56y\)
Ta thấy cứ 1 mol HCl lại tạo ra 0,5 H2
Mà : \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
\(\Rightarrow n_{HCl}=0,4\left(mol\right)\)
Ta có HPT : \(\left\{{}\begin{matrix}27x+56y=5,5\\3x+2y=0,4\end{matrix}\right.\)
Giải HPT ta được : \(x=0,1\left(mol\right),y=0,2\left(mol\right)\)
Ta có : \(m_{Al}=2,7\left(g\right)\)
\(m_{Fe}=11,2\left(g\right)\)
a ) \(\%Al=\dfrac{2,7}{11,2+2,7}.100\%\approx19,4\%\)
\(\Rightarrow\%Fe=100\%-19,4\%=80,6\%.\)
b ) Ta có : \(m_{HCl}=14,6\left(g\right)\)
Ta có : \(m_{dd\left(HCl\right)}=\dfrac{m_{HCl}}{C\%}=\dfrac{14,6}{\dfrac{14,6}{100}}=100\left(ml\right)\)
m\(m_{H_2}=0,4.2=0,8\)
\(m_{dd\left(sau\right)}=100+11,2+2,7-0,8=113,1\left(ml\right)\)
\(m_{AlCl_3}=0,1.133,5=13,35\left(g\right)\)
\(m_{FeCl_2}=0,2.127=25,4\left(g\right)\)
\(C\%=\dfrac{25,4+13,35}{113,1}.100\%\approx34,26\%.\)

thôi thì mình làm cho bn vậy, câu a ko làm dc đâu, làm câu b thôi, làm sao biết dc chất nào dư khi chỉ có số mol 1 chất?
nK2SO3=0.1367(mol)
mddH2SO4=Vdd.D=200.1,04=208(g)
K2SO3+H2SO4-->K2SO4+H2O+SO2
0.1367----0.1367----0.1367---------0.1367 (mol)
mddspu=100+208-0,1367.64=299.2512(g) ; mK2SO4=0,1367.174=23.7858(g)
==>C%=23.7858.100/299.512=7.94%
2)pt bn tự ghi nhé
ta có hệ pt: 56a+27b=11 và a+3b/2=8.96/22.4==>a=0.1, b=0.2
==>%Fe=0.1x56x100/11=50.9%
%Al=100%-50.9%=49.1%
b)nH2SO4= 0.7(mol)==>VddH2SO4=0.7/2=0.35(L)
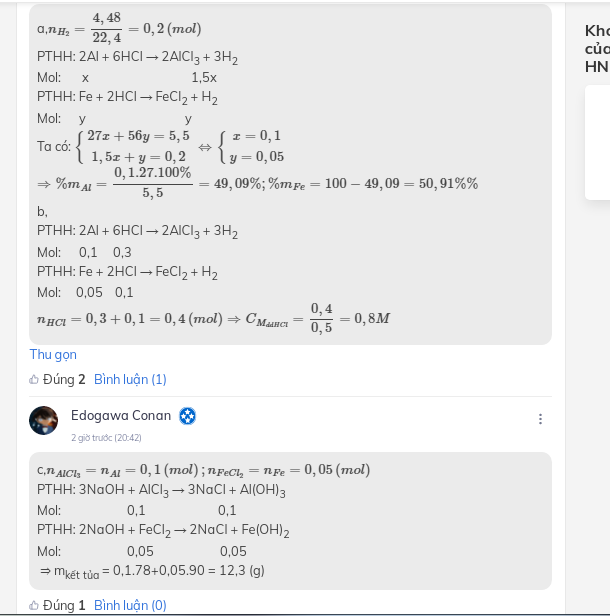
Đặt \(n_{Al}=x(mol);n_{Fe}=y(mol)\)
\(\Rightarrow 27x+56y=5,5(1)\\ n_{H_2}=\dfrac{4,48}{22,4}=0,2(mol)\\ 2Al+6HCl\to 2AlCl_3+3H_2\\ Fe+2HCl\to FeCl_2+H_2\\ \Rightarrow 1,5x+y=0,2(2)\\ (1)(2)\Rightarrow x=0,1(mol);y=0,05(mol)\\ a,\begin{cases} \%_{Al}=\dfrac{0,1.27}{5,5}.100\%=49,09\%\\ \%_{Fe}=100\%-49,09\%=50,91\% \end{cases}\\ b,\Sigma n_{HCl}=3x+2y=0,4(mol)\\ \Rightarrow m_{dd_{HCl}}=\dfrac{0,4.36,5}{14,6\%}=100(g)\)
\(n_{AlCl_3}=0,1(mol);n_{FeCl_2}=0,05(mol)\\ \Rightarrow C\%_{AlCl_3}=\dfrac{0,1.133,5}{0,1.27+100-0,15.2}.100\%=13,04\%\\ C\%_{FeCl_2}=\dfrac{0,05.127}{0,05.56+100-0,05.2}.100\%=6,18\%\)