Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Số mol của khí hidro ở dktc
nH2 =\(\dfrac{V_{H2}}{22,4}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Pt : X + 2HCl → XCl2 + H2\(|\)
1 2 1 1
0,1 0,1
Số mol của kim loại X
nX = \(\dfrac{0,1.1}{1}=0,1\left(mol\right)\)
⇒ MX = \(\dfrac{m_X}{n_X}=\dfrac{5,6}{0,1}=56\) (dvc)
Vậy kim loại x là Fe
⇒ Chọn câu : B Chúc bạn học tốt
\(R+2HCl \rightarrow RCl_2+H_2\\ n_{H_2}=\frac{2,24}{22,4}=0,1mol\\ M_R=\frac{5,6}{0,1}=56 g/mol\\ \Rightarrow R: Fe\)

Bài 1 :
$n_{H_2} = 0,1(mol)$
Bảo toàn khối lượng :
$m_{H_2O} = 32 + 0,1.2 - 23,2 = 9(gam)$
$n_{H_2O} = 0,5(mol)$
X gồm $R$ và $R_2O$
$2R + 2H_2O \to 2ROH + H_2$
$R_2O + H_2O \to 2ROH$
Theo PTHH :
$n_R = 2n_{H_2} = 0,2(mol)$
$n_{H_2O} = n_R + n_{R_2O}$
$\Rightarrow n_{R_2O} = 0,3(mol)$
Ta có :
$0,2R + 0,3(2R + 16) = 23,2 \Rightarrow R = 23(Natri)$
Vậy X gồm $Na,Na_2O$
$n_{CO_2} = 0,2(mol) ; n_{NaOH} = \dfrac{6}{40} = 0,15(mol)$
Ta có :
$n_{NaOH} : n_{CO_2} = 0,15 : 0,2 = 0,75 < 1$.
Chứng tỏ sinh ra muối axit
$NaOH + CO_2 \to NaHCO_3$
$n_{NaHCO_3} = n_{NaOH} = 0,15(mol)$
$m_{muốI} = 0,15.84 = 12,6(gam)$
a, Gọi CTTQ của kim loại và oxit lần lượt là R và $R_2O$
Theo gt ta có: $n_{H_2}=0,1(mol)$
Bảo toàn e ta có: $n_{R}=0,2(mol)$
Bảo toàn khối lượng ta có: $n_{H_2O}=0,5(mol)$
$\Rightarrow n_{R_2O}=0,3(mol)$
Do đó ta có: \(0,2.R+0,3.\left(2R+16\right)=23,2\Rightarrow R=23\)
Vậy hỗn hợp X chứa Na và $Na_2O$
b, Ta có: $n_{NaOH}=0,15(mol);n_{CO_2}=0,2(mol)$
$NaOH+CO_2\rightarrow NaHCO_3$
Sau phản ứng dung dịch chứa 0,15 mol $NaHCO_3$
$\Rightarrow m_{muoi}=12,6(g)$

Gọi hóa trị của M là n.
Ta có: \(n_{H_2}=\dfrac{5,376}{22,4}=0,24\left(mol\right)\)
PT: \(2M+nH_2SO_4\rightarrow M_2\left(SO_4\right)_n+nH_2\)
Theo PT: \(n_M=\dfrac{2}{n}n_{H_2}=\dfrac{0,48}{n}\left(mol\right)\)
\(\Rightarrow M_M=\dfrac{15,6}{\dfrac{0,48}{n}}=\dfrac{65}{2}n\left(g/mol\right)\)
Với n = 2 thì MM = 65 (g/mol)
Vậy: M là Zn.

1/ PT : X + 2H2O -> X[OH]2 + H2
mol : \(\frac{6}{M_X}\) -> \(\frac{6}{M_X}\)
=> mH2 = \(\frac{12}{M_X}\) => mdd = m+6 - \(\frac{12}{M_X}\)
Ta có: m+5,7 = m+6 - \(\frac{12}{M_X}\)
<=> \(\frac{12}{M_X}\)= 0,3 => MX = 40 => X là Canxi [Ca]
2/ Dặt nHCl= a [a> 0] => mddHCl= 36,5a : 14,6 x 100= 250a
PT : X + 2HCL => XCl2 + H2
mol : a/2 a -> a/2 a/2
mH2 = a/2 x 2 = a ; mX = a/2 . MX
m XCl2= a/2 x [MX +71]
mdd XCL2= a/2 .MX + 250a - a = a/2 .MX +249a
Ta có :\(\frac{\frac{a}{2}\times M_X+\frac{71}{2}a}{M_X\times a:2+249a}\times100\%=24,15\%\)
<=> \(\frac{M_X+71}{M_X+498}=24,15\%\Leftrightarrow M_X=65\)=> X là kẽm [Zn]

Gọi hóa trị của kim loại A là x
\(n_{H_2}=\frac{2,24}{22,4}=0,1\left(mol\right)\)
PTHH : 2A + 2xHCl -----> 2AClx + xH2
0,2/x mol 0,1mol
Áp dụng m = n.M , ta có : \(A.\frac{0,2}{x}=6,5\Rightarrow A=32,5x\)
Do x là hóa trị của kim loại nên x chỉ có thể là I , II hoặc III
Nếu x = 1 thì A = 32,5 (loại)
Nếu x = 2 thì A = 65 (nhận)
Nếu x = 3 thì A = 97,5 (loại)
Vậy A là kim loại Kẽm (Zn)
chỗ áp dụng là sao v bạn..? mình kh hiểu..đang tính khối lượng à bạn?

Phân tử khối của mỗi chất là: M = 1,875.32 = 60
Gọi CTPT là CxHyOz
+ z = 1: 12x + y = 44
Do 0 < H ≤ 2C + 2 => 0 < y ≤ 2x+2 => 0 < 44-12x ≤ 2x+2 => 3 ≤ x < 3,67 => x = 3
CTPT là C3H8O
+ z = 2: 12x + y = 28
Do 0 < H ≤ 2C + 2 => 0 < y ≤ 2x+2 => 0 < 28-12x ≤ 2x+2 => 1,857 ≤ x < 2,33 => x = 2
CTPT là C2H4O2
- Do X, Y, Z đều có khả năng phản ứng với Na nên có chứa nhóm –OH hoặc –COOH.
- Y tác dụng với dung dịch NaHCO3 nên Y là hợp chất axit. Công thức phân tử của Y là C2H4O2. Công thức cấu tạo của Y là CH3COOH.
- Khi oxi hóa X tạo X1 có khả năng tham gia phản ứng tráng gương nên X là ancol bậc 1. Công thức phân tử của X là C3H8O. Công thức cấu tạo của X là: CH3-CH2-CH2-OH.
- Chất Z có khả năng tham gia phản ứng tráng gương nên Z có chứa nhóm chức –CHO. Công thức phân tử của Z là C2H4O2. Công thức cấu tạo của Z là HO-CH2-CHO.
Chú ý:
+ Tác dụng với Na thì trong phân tử có nhóm – OH hoặc –COOH
+ Có phản ứng tráng bạc => trong phân tử có nhóm –CHO





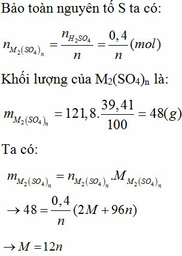

\(n_{H_2}=\dfrac{1.12}{22.4}=0.05\left(mol\right)\)
\(A+H_2O\rightarrow AOH+\dfrac{1}{2}H_2\)
\(0.1................................0.05\)
\(M_A=\dfrac{3.9}{0.1}=39\left(đvc\right)\)
\(A:K\left(kali\right)\)
cho mình hỏi 1/2 h2 là như nào vậy ạ. Mình cảm ơn