Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nH2 = 1,56822,41,56822,4= 0,07 (mol)
Gọi a,b,c lần lượt là số mol của Fe,Cr,Al
PTHH:
Fe + 2HCl ----> FeCl2 + H2↑↑
a mol------------------->a mol
Cr + 2HCl ----> CrCl2 + H2↑↑
b mol--------------------> b mol
2Al + 6HCl ---->2 AlCl3 + 3H2↑↑
c mol-----------------------> 1,5c mol
Ta có:
56a + 52b + 27c = 2,7 (1)
a + b + 1,5c = 0,07 (2)
PTHH:
2Fe + 3Cl2 t0→t0→ 2FeCl3
a mol--------> a mol
2Cr + 3Cl2 t0→t0→2CrCl3
b mol--------> b mol
2Al + 3Cl2 to→2AlCl3
c mol-------> c mol
Ta lại có:
162,5a + 158,5b + 133,5c = 9,09 (3)
Từ (1),(2),(3) ta có pt:
56a+52b+27c=2,7
a+b+1,5c=0,07
162,5a+158,5b+133,5c=9,09
=> a = b = c = 0,02
mAl = 0,02 . 27 = 0,54(g)

Đặt \(\left\{{}\begin{matrix}n_{Mg}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\\n_{Zn}=c\left(mol\right)\\n_{Al}=d\left(mol\right)\end{matrix}\right.\) \(\Rightarrow95a+127b+136c+133,5d=40,45\) (1)
Sau p/ứ với Clo, ta được: \(95a+162,5b+136c+133,5d=44\) (2)
Lấy PT (2) trừ PT (1) \(\Rightarrow35,5b=3,55\) \(\Rightarrow b=n_{Fe}=0,1\left(mol\right)\)
\(\Rightarrow\%m_{Fe}=\dfrac{0,1\cdot56}{13,47}\cdot100\%\approx41,57\%\)

\(n_{Fe}=a\left(mol\right),n_{Mg}=b\left(mol\right),n_{Al}=c\left(mol\right),n_{Zn}=d\left(mol\right)\)
\(n_{H_2}=\dfrac{2.24}{22.4}=0.1\left(mol\right)\)
\(\)\(BTe:\)
\(2a+2b+3c+2d=0.2\left(1\right)\)
\(n_{Cl_2}=\dfrac{3.36}{22.4}=0.15\left(mol\right)\)
\(BTe:\)
\(3a+2b+3c+2c=0.15\cdot2=0.3\left(2\right)\)
\(\left(2\right)-\left(1\right):a=0.3-0.2=0.1\)
\(\%Fe=\dfrac{0.1\cdot56}{32}\cdot100\%=17.5\%\)

Gọi a,b lần lượt là số mol của Al, Fe trong hỗn hợp ban đầu
=> 27a+56b=8,3 (1)
\(n_{H_2}=\dfrac{5,6}{22,4}=0,25mol\)
Ta có quá trình trao đổi elcetron
\(Al^0\rightarrow Al^{+3}+3e\)
a----------------3a--(mol)
\(Fe^0\rightarrow Fe^{+2}+2e\)
b----------------2b--(mol)
\(2H^{-1}+2e\rightarrow H_2^0\)
----------0,5------0,25-(mol)
Áp dụng định luật bảo toàn e ta có: 3a+2b=0,5 (2)
Giải hệ phương trình gồm (1) và (2) ta được: \(\left\{{}\begin{matrix}a=0,1\\b=0,1\end{matrix}\right.\)
\(\left[{}\begin{matrix}m_{Al}=0,1\cdot27=2,7g\\m_{Fe}=0,1\cdot56=5,6g\end{matrix}\right.\)

E có 1 chút nhầm lẫn ở câu cuối
Mg + 2HCl ‐> MgCl + H ﴾1﴿ 2Al + 6HCl ‐> 2AlCl + 3H ﴾2﴿ Fe + 2HCl ‐> FeCl + H ﴾3﴿
Mg + 2HCl -> MgCl2 + H2 (1)
2Al + 6HCl -> 2AlCl3 + 3H2 (2)
Fe + 2HCl -> FeCl2 + H2 (3)
Theo bài ra ta có : nH2 =\(\frac{8,69}{22,4}\) = 0,4 (mol)
Thep ptpu (1)(2)(3) ta thấy
nHCl = 2nH2 = 0,4 .2 = 0,8 (mol)
=> m HCl = 0,8 .36,5 = 26,8 (g)
Ap dụng định luật bảo toàn khối lượng : m hỗn hợpMg ,Al,Fe +m HCl= m muối MgCl2 , ALCL3, FeCl2 +mH2
(=) 15+26,8 =m+0,4.2
(=) 41,8 =m +0,8
=> m=41,8 =0,8=41(g)

Bạn xem hỗn hợp ban đầu được tạo thành từ: Fe, Cu và O2
Fe -------> Fe3+ + 3e
x.........................3x
Cu -------> Cu2+ + 2e
y..........................2y
O2 + 4e -----> 2O2-
z.........4z
S+6 + 2e -------> S+4
...........0,045..........0,0225
Gọi x, y, z là số mol Fe, Cu, O2. Ta có hpt:
56x + 64y + 32z = 2,44
3x + 2y = 4z + 0,045
0,5*400x + 160y = 6,6
=> x = 0,025, y = 0,01, z = 0,0125
=> %mCu = 0,01*64/2,44*100% = 26,23%
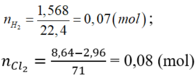
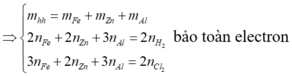
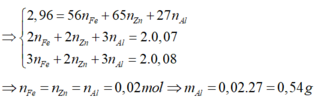
nH2 = \(\dfrac{1,568}{22,4}\)= 0,07 (mol)
Gọi a,b,c lần lượt là số mol của Fe,Cr,Al
PTHH:
Fe + 2HCl ----> FeCl2 + H2\(\uparrow\)
a mol------------------->a mol
Cr + 2HCl ----> CrCl2 + H2\(\uparrow\)
b mol--------------------> b mol
2Al + 6HCl ---->2 AlCl3 + 3H2\(\uparrow\)
c mol-----------------------> 1,5c mol
Ta có:
56a + 52b + 27c = 2,7 (1)
a + b + 1,5c = 0,07 (2)
PTHH:
2Fe + 3Cl2 \(\underrightarrow{t^0}\) 2FeCl3
a mol--------> a mol
2Cr + 3Cl2 \(\underrightarrow{t^0}\)2CrCl3
b mol--------> b mol
2Al + 3Cl2 \(\underrightarrow{t^0}\)2AlCl3
c mol-------> c mol
Ta lại có:
162,5a + 158,5b + 133,5c = 9,09 (3)
Từ (1),(2),(3) ta có pt:
\(\left\{{}\begin{matrix}56a+52b+27c=2,7\\a+b+1,5c=0,07\\162,5a+158,5b+133,5c=9,09\end{matrix}\right.\)
=> a = b = c = 0,02
mAl = 0,02 . 27 = 0,54(g)