Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
· Có n Al ( B ) = 2 3 . n H 2 = 2 3 . 0 , 672 22 , 4 = 0 , 02 mol
· Chất rắn thu được sau khi nung là Al2O3:
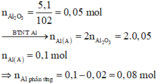
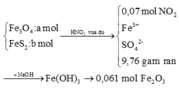
· Quy đổi A tương đương với hỗn hợp gồm 0,1 mol Al, a mol Fe, b mol O
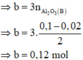
· Phần không tan D gồm Fe và oxit sắt + H2SO4 ® Dung dịch E + 0,12 mol SO2
Dung dịch E chứa một muối sắt duy nhất và không hòa tan được bột Cu
Þ Muối sắt là FeSO4.
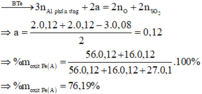

Đáp án A
Ta có sơ đồ phản ứng:
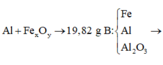
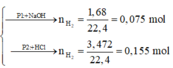
Phần 1:
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
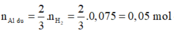
![]()
Phần 2:
2Al + 6HCl → 2AlCl3 + 3H2↑ (1)
0,05 → 0,075
Fe + 2HCl → FeCl2 + H2↑ (2)
![]()
![]()
![]()
![]()
Ta có phương trình phản ứng:
![]()
Khối lượng các chất trong 1 phần hỗn hợp B là 19,82/2 = 9,91 g
![]()
![]()
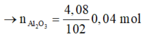
Ta có:
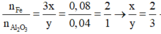
=> Oxit sắt cần tìm là Fe2O3

+ Tính được những gì có thể tính được
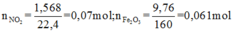
+ Với bài toán gồm nhiều giai đoạn liên tiếp nhau như thế này ta nên tóm tắt lại bài toán:
Bây giờ ta phải thiết lập được mối quan hệ giữa a và b với hi vọng là tìm được a và b rồi sau đó áp dụng các định luật bảo toàn như khối lượng, nguyên tố, electron ....
+ Bảo toàn nguyên tố Fe: 3a + b = nFe = 2.0,061 = 0,122
+ Bảo toàn sốmol electron trao đổi: a + 15b = 0,07.1 ( Chú ý FeS2→Fe3+ + 2S+6 + 15e)
Giải được a = 0,04; b = 0,002.
+ Tiếp tục sử dụng bảo toàn nguyên tố S:
![]()
+ Vì phản ứng xảy ra hoàn toàn và vừa đủ nên sau khi phản ứng với dung dịch NaOH ta chỉ thu được 2 muối là Na2SO4 và NaNO3.
Áp dụng định luật bảo toàn nguyên tố Na:
![]()
+ Cuối cùng dựa vào sơ đồ tóm tắt, ta sẽ dùng bảo toàn nguyên tố N
![]()
=>![]()
Đáp án D

Câu hỏi của lam nguyễn lê nhật - Hóa học lớp 8 | Học trực tuyến



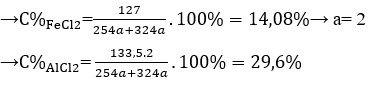

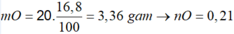
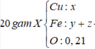
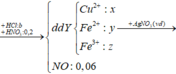
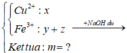
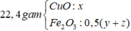
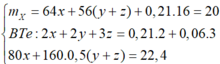
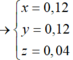
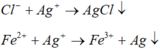
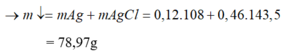
a) Gọi x,y lần lượt là số mol \(Al_2O_3\) và \(Fe_2O_3\) trong hỗn hợp ban đầu.
\(\Rightarrow102x+160y=21,1\) (1)
\(n_{HCl}=6.0,15=0,9\) mol
\(Al_2O_3+6H^+\rightarrow2Al^{3+}+3H_2O\)
x -------> 6x -----> 2x
\(Fe_2O_3+6H^+\rightarrow2Fe^{3+}+3H_2O\)
y --------> 6y ------> 2y
\(\Rightarrow6x+6y=0,9\) (2)
Giải hệ (1)(2) được x = 0,05 mol, y = 0,1 mol
\(\Rightarrow\%m_{Al_2O_3}=\dfrac{102.0,05}{21,1}.100\%=24,17\%\)
\(\Rightarrow\%m_{Fe_2O_3}=100\%-24,17\%=75,83\%\)
b) Dung dịch thu được gồm 0,1 mol \(AlCl_3\) và 0,2 mol \(FeCl_3\)
\(V_{dd}=0,15\) lít \(\Rightarrow C_M\left(AlCl_3\right)=\dfrac{0,1}{0,15}=0,67M\)
\(C_M\left(FeCl_3\right)=\dfrac{0,2}{0,15}=1,33M\)
(Do không cho khối lượng riêng của HCl nên không thể tính được mdd)
c) Nếu cho gấp đôi hỗn hợp Oxit kim loại trên vào 50 gam dung dịch NaOH 3% thì:
\(n_{Fe_2O_3}=0,2\) mol ; \(n_{Al_2O_3}=0,1\) mol; \(n_{NaOH}=\dfrac{3\%.50}{40}=0,0375\) mol
Chỉ có \(Al_2O_3\) phản ứng với NaOH:
\(Al_2O_3+2NaOH+3H_2O\rightarrow2NaAl\left(OH\right)_4\)
0,01875<--0,0375---------------> 0,0375
Dung dịch thu được gồm 0,0375 mol NaAl(OH)4
\(m_{dd}=42,2+50-0,2.160-\left(0,1-0,01875\right).102=51,9125\) gam
\(C\%_{NaAl\left(OH\right)_4}=\dfrac{0,0375.118}{51,9125}.100\%=8,524\%\)