Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

R2O3+6HCl->2RCl3+3H2O
nHCl=0.3(mol)
->nR=0.05(mol)->MR2O3=8:0.05=160(g/mol)
->MR=(160-16*3):2=56(g/mol)->M là Fe
Bài 2
nH2=0.3(mol)
2X+2nHCl->2XCln+nH2(n là hóa trị của kim loại)
nX=0.6:n
+) n=1->MX=9(g/mol)->loại
+)n=2->MX=18(g/mol)->loại
+)n=3->MX=27(g/mol)->X là Al
Bài cuối bạn viết phương trình,chỉ phương trình Al+H2SO4 mới tạo khí thôi,vậy bạn tính được khối lượng nhôm,từ đó tính ra khối lượng nhôm oxit nhé,vì đang vội nên mình không giải giúp bạn được
Bài 3
nH2 = \(\frac{13,44}{22,4}\) = 0,6 mol
2Al + 3H2SO4 \(\rightarrow\) Al2(SO4)3 + 3H2 \(\uparrow\) (1)
0,4 <---- 0,6 <-------- 0,2 <------ 0,6 (mol)
Al2O3 + 3H2SO4 \(\rightarrow\) Al2(SO4)3 + 3H2O (2)
a) %mAl = \(\frac{0,4.27}{31,2}\) . 100% = 34,62%
%mAl2O3 = 65,38%
b) nAl2O3 = \(\frac{31,2-0,4.27}{102}\) = 0,2 (mol) = nAl2(SO4)3
Theo pt(2) nH2SO4 = 3nAl2O3 = 0,6 (mol)
m dd H2SO4 = \(\frac{\left(0,6+0,6\right)98}{20\%}\) = 588(g)
c) m dd spư = 31,2 + 588 - 0,6 . 2 = 618 (g)
C%(Al2(SO4)3) = \(\frac{\left(0,2+0,2\right)342}{618}\) . 100% = 22,14%

\(a,n_{H_2}=\dfrac{4,48}{22,4}=0,2mol\\
Fe+2HCl\rightarrow FeCl_2+H_2\\
n_{Fe}=n_{H_2}=0,2mol\\
m_{Fe}=0,2.56=11,2g\\
m_{Cu}=25-11,2=13,8g\\
b,\%m_{Fe}=\dfrac{11,2}{25}\cdot100=44,8\%\\
\%m_{Cu}=100-44,8=55,2\%\)
c, Gọi CTHH của sắt là \(Fe_xO_y\)
\(Fe_xO_y+yH_2\xrightarrow[t^0]{}xFe+yH_2O\\ \Rightarrow n_{Fe_xO_y}=n_{H_2}:y\\ \Leftrightarrow\dfrac{11,6}{56x+16y}=\dfrac{0,2}{y}\\ \Leftrightarrow11,6y=11,2x+3,2y\\ \Leftrightarrow11,6y-3,2y=11,2x\\ \Leftrightarrow8,4y=11,2x\\ \Leftrightarrow\dfrac{x}{y}=\dfrac{8,4}{11,2}=\dfrac{3}{4}\\ \Rightarrow x=3;y=4\\ \Rightarrow CTHH:Fe_3O_4\)

a) PTHH: 2Al + 6 HCl -> 2 AlCl3 + 3 H2
x___________3x______________1,5x(mol)
Fe +2 HCl -> FeCl2 + H2
y___2y____y______y(mol)
b) Ta có: m(rắn)= mCu=0,4(g)
=> m(Al, Fe)=1,5-mCu=1,5-0,4=1,1(g)
nH2= 0,04(mol)
Ta lập hpt:
\(\left\{{}\begin{matrix}27x+56y=1,1\\1,5x+y=0,04\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,02\\y=0,01\end{matrix}\right.\)
=> mAl=27.0,02=0,54(g)
mFe=56.0,01=0,56(g)

\(a)n_{H_2}=\dfrac{8,96}{22,4}=0,4mol\\ n_{Fe}=a;n_{Al}=b\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(\Rightarrow\left\{{}\begin{matrix}56a+27b=11\\a+1,5b=0,4\end{matrix}\right.\\ \Rightarrow a=0,1;b=0,2\)
\(\%m_{Fe}=\dfrac{0,1.56}{11}\cdot100=50,91\%\\ \%m_{Al}=100-50,91=49,09\%\)
\(b)Fe+2HCl\rightarrow FeCl_2+H_2\)
0,1 0,2 0,1 0,1
\(2Al+6HCl\rightarrow2AlCl_2+3H_2\)
0,2 0,6 0,2 0,3
\(m_{HCl}=\dfrac{\left(0,2+0,6\right).36,5}{9,125}\cdot100=320g\)
\(c)m_{dd}=320+11-0,1.2-0,3.2=308,2g\)
\(C_{\%FeCl_2}=\dfrac{0,1.127}{308,2}\cdot100=4,12\%\\ C_{\%AlCl_3}=\dfrac{0,2.133,5}{308,2}\cdot100=8,66\%\)

a, Ta có: 24nMg + 56nFe = 12,8 (1)
PT: \(Mg+2HCl\rightarrow MgCl_2+H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
Theo PT: \(n_{H_2}=n_{Mg}+n_{Fe}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{Mg}=0,3\left(mol\right)\\n_{Fe}=0,1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Mg}=0,3.24=7,2\left(g\right)\\m_{Fe}=0,1.56=5,6\left(g\right)\end{matrix}\right.\)
b, \(n_{HCl}=2n_{H_2}=0,8\left(mol\right)\)
\(\Rightarrow V_{HCl}=\dfrac{0,8}{2}=0,4\left(l\right)\)
c, \(MgCl_2+2NaOH\rightarrow Mg\left(OH\right)_2+2NaCl\)
\(FeCl_2+2NaOH\rightarrow Fe\left(OH\right)_2+2NaCl\)
Theo PT: \(\left\{{}\begin{matrix}n_{Mg\left(OH\right)_2}=n_{MgCl_2}=n_{Mg}=0,3\left(mol\right)\\n_{Fe\left(OH\right)_2}=n_{FeCl_2}=n_{Fe}=0,1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow m_{\downarrow}=0,3.58+0,1.90=26,4\left(g\right)\)
a. Số gam mỗi kim loại trong hỗn hợp ban đầu:
Mg: 9,6 gamFe: 22,4 gamb. Thể tích dung dịch HCl 2M đã phản ứng: 0,2 lít
c. Khối lượng kết tủa thu được khi dd A tác dụng với dung dịch NaOH dư là 0,4 gam.
------------------------------------đấy

Câu 1
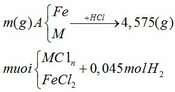
Áp dụng định luật bảo toàn nguyên
tố H ta có:
nHCl = 2nH2 = 2.0,045 = 0,09 mol
Áp dụng định luật bảo toàn khối lượng
ta có: mA + mHCl = m muối + mH2
=> m = m muối + mH2 – mA = 4,575 + 0,045.2 – 0,09.36,5 = 1,38 (gam)
Câu 2
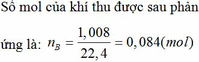
Do cho kim loại phản ứng với H2SO4 đặc và HNO3 đặc nên khí sinh ra là SO2 và NO2.
Áp dụng phương pháp đường chéo ta có:
SO2: 64 4,5
50,5
NO2: 46 13,5
→nSO2=nNO2=4,513,5=13
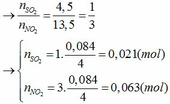
Đặt số mol của Fe và M lần lượt là x và y (mol)
- Khi cho hỗn hợp tác dụng với HCl:
Fe + 2HCl → FeCl2 + H2
x x (mol)
M + nHCl → MCln + 0,5nH2
y 0,5ny (mol)
nH2 = 0,045 => x + 0,5ny = 0,045 (1)
- Khi cho hỗn hợp tác dụng với HNO3 đặc và H2SO4 đặc:
Ta có các bán phản ứng oxi hóa – khử:
Fe → Fe3+ + 3e
x 3x
M → Mn+ + ne
y ny
S+6 + 2e → S+4 (SO2)
0,021 0,042
N+5 + 1e → N+4 (NO2)
0,063 0,063
Áp dụng định luật bảo toàn electron ta có: 3x + ny = 0,042 + 0,063 hay 3x + ny = 0,105 (2)
Từ (1) và (2) ta có hệ phương trình sau:
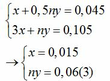
Mặt khác: mA = mFe + mM => 1,38 = 0,015.56 + My => My = 0,54(4)
Từ (3) và (4) suy ra M = 9n
Ta có bảng sau:
| n |
1 |
2 |
3 |
| M |
9 (loại) |
18 (loại) |
27 (nhận) |
Vậy kim loại M là nhôm, kí hiệu là Al.

nH2 = \(\frac{2,24}{22,4}\) = 0,1 (mol)
Fe + 2HCl \(\rightarrow\) FeCl2 + H2
0,1 <------------- 0,1 <--- 0,1 (mol)
a) mFe = 0,1 . 56 = 5,6 (g)
mCu = 4 (g)
b) mFeCl2 = 0,1 . 127= 12,7 (g)
c) Gọi nZn pư = x (mol)
Zn + FeCl2 \(\rightarrow\) ZnCl2 + Fe
x ----->x --------> x -------> x (mol)
Khối lượng CR giảm là khối lượng của sắt sinh ra.
=> 65x - 56x = 100 - 99,55
\(\Rightarrow\) x = 0,05
Sau pư thể tích ko đổi nên V = 0,1 (l)
CM(ZnCl22) = \(\frac{0,05}{0,1}\) = 0,5 (M)
nFeCl2 dư = 0,1 - 0,05 = 0,05 (mol)
CM(FeCl2) = \(\frac{0,05}{0,1}\) = 0,5 (M)
Xin lỗi lượng khí H2 là 1,064 lít mới đúng . mình viết lộn ở trên