Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn đáp án C
Giả sử KOH tác dụng với X thì KOH hết ⇒ n KNO 3 = n KOH = 0 , 5 mol.
⇒ m KNO 3 = 0 , 5 x 101 = 50 , 5 gam gam > 41,05 gam ⇒ vô lí ⇒ KOH dư.
Đặt n KOH dư = x mol; n KNO 3 = y mol
![]()
Phản ứng:
![]()
Giải hệ có: x = 0,05 mol; y = 0,45 mol
![]()
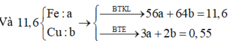
Đặt n Fe = a mol; n Cu = b mol ⇒ m A = 56 a + 64 b = 11 , 6 gam.
Do KOH dư ⇒ kết tủa hết ion kim loại ⇒ nung T thì rắn gồm Fe2O3 và CuO.
⇒ mrắn = 41,05 = 0,5a × 160 + 80b. Giải hệ có: a = 0,15 mol; b = 0,05 mol.
Quy hỗn hợp B về N và O. Bảo toàn nguyên tố nitơ có nN spk = 0,7 – 0,45 = 0,25 mol.
![]()
⇒ dung dịch chứa ion Fe2+, Fe3+ và H+ hết.!
Bảo toàn nguyên tố hidro có n H 2 O = 0 , 7 ÷ 2 = 0 , 35 mol.
⇒ bảo toàn nguyên tố oxi có nO sk = 0,7 × 3 – 0,45 × 3 – 0,35 = 0,4 mol.
⇒ BTKL mdung dịch sau phản ứng = 11,6 + 87,5 – 0,25 × 14 – 0,4 × 16 = 89,2 gam.
![]()

Đáp án : B
Vì kim loại tan hết nên HNO3 dư
Khi X + KOH => thu được kết tủa
+) Giả sử KOH dư => chất rắn 16,0g gồm Fe2O3 ; CuO (*)
Khi đó T gồm KNO3 và KOH => Nung lên thành KNO2 và KOH với số mol lần lượt là x và y
=> 41,05 = 85x + 56y
Và nK = 0,5 = x + y
=> x = 0,45 mol ; y = 0,05 mol
Gọi số mol Fe và Cu trong A lần lượt là a và b mol
=> 56a + 64b = 11,6g
Và 80a + 80b = 16g (*)
=> a = 0,15 mol ; b = 0,05 mol
+) Nếu chỉ có Fe3+ và Cu2+ => nKOH < 3nFe + 2nCu ( Vô lí )
=> Trong X có Fe2+ : u mol và Fe3+ : v mol
=> HNO3 phải hết
=> u + v = 0 , 15 2 u + 3 v = 0 , 45 => u = 0 , 1 v = 0 , 05
Có nFe(NO3)3 = 0,05 mol
Ta thấy mN2 < mB < mNO2
=> 0,35.28 < mB < 46.0,7
=> 9,8 < mB < 32,2g
BTKL : 66,9g < mdd sau < 89,3g
=> 13,55% < %mFe(NO3)3 < 18,09%

Đáp án B
► Giả sử KOH không dư ||⇒ nKNO2 = nKOH = 0,5 mol ⇒ mrắn ≥ mKNO2 = 42,5(g)
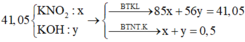
⇒ vô lí!. ⇒ KOH dư. Đặt nKNO3 = x; nKOH dư = y. Bảo toàn nguyên tố Kali: x + y = 0,5.
Rắn gồm KNO2 và KOH dư ⇒ 85x + 56y = 41,05 ||⇒ giải hệ có: x = 0,45 mol; y = 0,05 mol.
● Đặt nFe = a; nCu = b ⇒ mA = 56a + 64b = 11,6(g) || 16(g) rắn gồm Fe2O3 và CuO.
⇒ 160.0,5a + 80b = 16 ||⇒ giải hệ có: a = 0,15 mol; b = 0,05 mol.
nHNO3 = 0,7 mol; nNO3–/X = nKNO3 = 0,45 mol. Bảo toàn nguyên tố Nitơ: nN/B = 0,25 mol.
Bảo toàn nguyên tố Hidro: nH2O = 0,35 mol. Bảo toàn nguyên tố Oxi: nO/B = 0,4 mol.
||⇒ Bảo toàn khối lượng: mX = 11,6 + 87,5 – 0,25 × 14 – 0,4 × 16 = 89,2(g).
► nNO3–/X < 3nFe + 2nCu ⇒ X gồm muối Fe(NO3)2, Fe(NO3)3 và Cu(NO3)2.
Giải hệ có: nFe(NO3)3 = 0,05 mol ||⇒ C%Fe(NO3)3 = 0,05 × 242 ÷ 89,2 × 100% = 13,56%

Chọn A.
Gọi a và b lần lượt là số mol của Fe và Cu. Xét hỗn hợp chứa 20 gam Fe2O3 và CuO ta có:
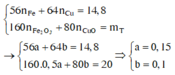
Dung dịch T gồm K+, Na+, OH- và NO3-. Khi nung chất rắn khan T thì:
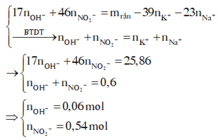
Dung dịch X gồm Fe2+, Fe3+, Cu2+(0,2 mol) và NO3-
(với n C O 3 - = n N O 2 - = 0 , 54 m o l ).
+ Xét X có:
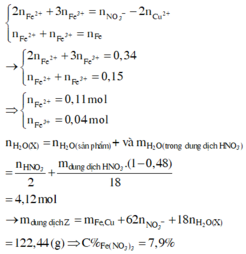

Chọn B.
Gọi a và b lần lượt là số mol của Fe và Cu. Xét hỗn hợp chứa 20 gam Fe2O3 và CuO ta có :
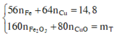
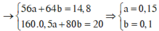
Dung dịch T gồm K+, Na+, OH- và NO3-. Khi nung chất rắn khan T thì :
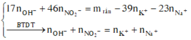

Dung dịch X gồm Fe2+, Fe3+, Cu2+(0,2 mol) và NO3- (với ). Xét X có:
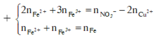
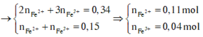
![]()
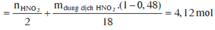
![]()
![]()

Đáp án : D
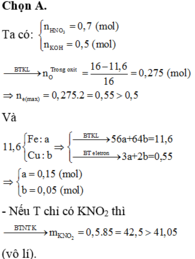
Ta có : nKOH = 0,5 (mol)
Ta nhận xét nhanh như sau :
Nếu KOH thiếu thì Z sẽ là KNO3 và các muối của kim loại
(bảo toàn nguyên tố K)
→ m chất rắn
→ m K N O 2 = 0,5.(39 + 46) = 41,5 (vô lý).
(bảo toàn nguyên tố K)
→ 41 , 05 K N O 2 : 0 , 45 K O H : 0 , 05
(bảo toàn khối lượng)
→ nO trong oxit = 0,275 → B T e ne = 0,55 (mol)
→ 11 , 6 F e : 0 , 15 m o l C u : 0 , 05 m o l
Và n H N O 3 =0,7(mol) → B T N T . H = n H 2 O sin h r a = 0,35 (mol)
Vậy trong X có :
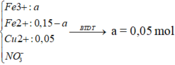
→ B T K L 11,6 + 0,7.63 = 11,6 + 0,45.62 + mB + 0,35.18
→ mB = 9,9 gam
→ %mFe(NO3)3 = 13,56%
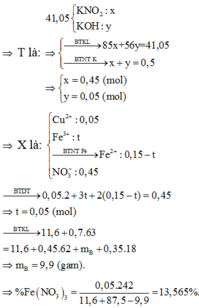

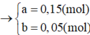

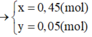
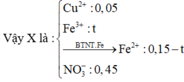
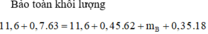
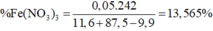
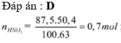
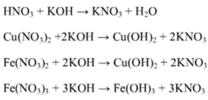
Chọn C