Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi CTHH oxit kim loại là \(RO\)
Giả sử có 1mol oxit pứ
\(RO+H_2SO_4\rightarrow RSO_4+H_2O\)
\(1-\rightarrow1---\rightarrow1\)
\(m_{ddH_2SO_4}=\dfrac{1.98}{4,9}\cdot100=2000\left(g\right)\\ m_{ddRSO_4}=1\left(R+16\right)+2000=2016+R\left(g\right)\\ C_{\%RSO_4}=\dfrac{1\left(R+96\right)}{2016+R}\cdot100=5,88\%\\ \Rightarrow R\approx24\left(g/mol\right)\)
Vậy R là Mg

Chọn C
Gọi công thức của oxit hóa trị II là RO
Đặt mol RO = 1 (mol)
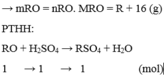
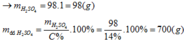
![]()
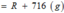
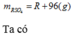

Vậy công thức của oxit kim loại là MgO

Gọi CT của oxit : RO
n RO = a ( mol )
PTHH:
RO + H2SO4 ====> RSO4 + H2O
a--------a------------------a
theo pthh:
n H2SO4 = n RSO4 = n RO = a ( mol )
Có: n H2SO4=a ( mol ) => m H2SO4 = 98a ( g )
=> m dd H2SO4 20% = 490a ( g )
BTKL: m dd sau phản ứng = a ( R + 16 ) + 490a = aR + 506a ( g )
Lại có :
n RSO4 = a ( mol ) => m RSO4 = aR + 96a
=> \(\dfrac{aR+96a}{aR+506a}=\dfrac{22,64}{100}\Rightarrow\dfrac{a\left(R+96\right)}{a\left(R+506\right)}=\dfrac{22,64}{100}\)
\(\Rightarrow R=24\left(Mg\right)\)
Vậy CT: MgO

Tham khảo
Gọi m_ddH2SO4 = 294 gam → nH2SO4 =0,6 mol
R2O3 + 3H2SO4 → R2(SO4)3 +3H2O
0,2 0,6 0,2 0,6
=> m = 294 + 9,6 + 0,4R
=> 0,2(2R + 96.3)/303,6 + 0,4R = 0,21756
=> R = 27 => R = AI
b ơi cái này người ta cho kim loại chứ k phải oxit của kim loại, mà kim loại hóa trị 2 chứ không phải 3 nha :<

a/ CT oxit: $CuO$
b/ Vậy CT X: $CuSO_4.5H_2O$
Giải thích các bước giải:
Gọi công thức oxit là: $MO$
Số mol oxit là a mol
$MO+H_2SO_4\to MSO_4+H_2O$
Theo PTHH
$n_{H_2SO_4}=n_{MSO_4}=n_{MO}=a\ mol$
$⇒m_{dd\ H_2SO_4}=\dfrac{98a.100}{24,5}=400a$
$⇒m_{dd\ A}=a.(M+16)+400a = aM+416a$
$m_{MSO_4}=a.(M+96)$
Do nồng độ muối là 33,33% nên:
$\dfrac{a.(M+96)}{aM+416a}.100\%=33,33\\⇒M=64$
Vậy M là Cu, công thức oxit: $CuO$
b.
Trong 60 gam dung dịch muối A có:
$m_{CuSO_4}=\dfrac{60.33,33}{100}=20g$
Gọi công thức tinh thể tách ra là: $CuSO_4.nH_2O$
Khối lượng dung dịch còn lại là:
$60-15,625=44,375g ⇒ m_{CuSO_4\ trong\ dd}=\dfrac{44,375.22,54}{100}=10g$
$⇒m_{CuSO_4\ trong\ tinh\ thể}=20-10=10g$
$⇒n_{tinh\ thể}=n_{CuSO_4}=0,0625\ mol$
$⇒M_{tinh\ thể}=15,625:0,0625=250⇒n=5$
Vậy CT X: $CuSO_4.5H_2O$

a) Gọi công thức oxit là: MO
Số mol oxit là a mol
MO+H2SO4→MSO4+H2O
Theo PTHH
nH2SO4=nMSO4=nMO=a mol
⇒mdd H2SO4=98a.100/24,5=400a
⇒mdd A=a.(M+16)+400a=aM+416a
mMSO4=a.(M+96)
Do nồng độ muối là 33,33% nên:
a.(M+96)/aM+416a.100%=33,33⇒M=64
Vậy M là Cu, công thức oxit: CuO

Gọi x là hóa trị của kim loại
Gỉa sử kim loại tham gia 1 mol => Ta có PTHH:
2R + xH2SO4 ---------> A2(SO4)x + xH2
1.........x\2.....................1\2.............x\2 (mol)
Ta có : mA = 1 . MA = A(g) ; mH2SO4= \(\frac{98x}{2}\) (g)
=> mddH2SO4 =\(\frac{\frac{98x}{2}.100}{9.8}\) = 500x (g)
=> mdd sau phản ứng = mH2SO4 + mA - mH2 = 500x + A - x (g)
=> mmuối sunfat= \(\frac{2A+96x}{2}\)(g)
Vậy nồng độ muối sau phản ứng là \(\frac{\frac{2A+96x}{2}}{500x+A-x}=\frac{15.14}{100}\)
=> A = \(\frac{2754.86}{84.86}\) x
Xét x = 1 thì A là 32.46358708 [ A là Lưu huỳnh (loại)]
x = 2 thì A là 64.92717417 [A là Zn ( nhận)]
x = 3 thì A là 97.39076125 (loại)
Vậy kim loại tham gia phản ứng là Kẽm (Zn)

\(MO+H_2SO_4->MSO_4+H_2O\\ m_{ddH_2SO_4}=100g\left(tự.chọn\right)\\ C\%_{sau}=\dfrac{11,8}{100}=\dfrac{\dfrac{100.0,1}{98}\left(M+96\right)}{\dfrac{100.0,1}{98}\left(M+16\right)+100}\\ M=24\left(Mg\right)\\ CT:MgO\)

Gọi: CTHH của bazo : M(OH)2
Giải sử :
nM(OH)2 = 1 mol
M(OH)2 + H2SO4 --> MSO4 + 2H2O
1__________1_________1
mH2SO4 = 98 g
mdd H2SO4 = 490 g
mdd sau phản ứng = M + 34 + 490 = M + 524 g
mMSO4 = M + 96 g
C%MSO4 = (M+96)/(M+524)*100% = 21.9%
<=> M \(\approx\) 24
Vậy: CTHH : Mg(OH)2
Bạn xem lại có sai đề k, mk làm k ra