Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Bài 3 :
\(3,040Fe;Cu+HNO3\left(l\right)->\left\{{}\begin{matrix}Fe\left(NO3\right)3\\Cu\left(NO3\right)2\end{matrix}\right.+0,896\left(l\right)NO\)
Gọi Fe là x , Cu là y
Ta có :
nNO = 0,04 ( mol )
Feo - 3e -> Fe+3
x 3x
Cuo - 2e -> Cu+2
y 2y
N+5 + 3e -> N+2
0,12 <- 0,04
n(e) cho = n(e) nhận
Ta có hpt :
\(\left\{{}\begin{matrix}56x+64y=3,040\\3x+2y=0,12\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,02\left(mol\right)\\y=0,03\left(mol\right)\end{matrix}\right.\)
Xác đinh phần trăm khối lượng trong kim loại :
\(\left\{{}\begin{matrix}\%mFe=\dfrac{56.0,02}{3,04}=36,84\%\\\%mCu=\dfrac{64.0,03}{3,04}=63,15\%\end{matrix}\right.\)

Đáp án A
Các phản ứng xảy ra:
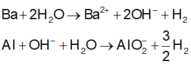
Vì thể tích H2 thu được ở hai trường hợp không bằng nhau nên khi hòa tan hỗn hợp vào nước dư thì còn một phần kim loại Al dư không tan.
Gọi n Ba = a n Al = b

Vậy m = mBa + mA1 = 24,5 (gam)


\(a,PTHH:2K+2H_2O\rightarrow2KOH+H_2\)
\(n_{H_2}=\dfrac{V}{22,4}=\dfrac{15,68}{22,4}=0,7\left(mol\right)\)
\(b,Theo.PTHH:n_K=2.n_{H_2}=2.0,7=1,4\left(mol\right)\\ m_K=n.M=1,4.39=54,6\left(g\right)\)
39 lấy ở đâu vậy ạ