Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
Hướng dẫn Gọi số mol oxit MO = x mol
MO + H2SO4 ® MSO4 + H2O
(mol): x x x
Ta có: (M + 16)x = a
Khối lượng dung dịch axit H2SO4 ban đầu = ![]() = 560x (gam)
= 560x (gam)
Khối lượng dung dịch sau phản ứng = a + 560x = (M + 16)x + 560x
Theo bài: C% (MSO4) = 20% nên: ![]()
Từ đây tìm được M = 24 (magie). Oxit kim loại cần tìm là MgO

Đáp án B
Hướng dẫn
Gọi số mol oxit MO = x mol.
MO + H2SO4 → MSO4 + H2O
(mol): x x x
Ta có: (M + 16)x = a
Khối lượng dung dịch axit H2SO4 ban đầu ![]() = 560x (gam)
= 560x (gam)
Khối lượng dung dịch sau phản ứng = a + 560x = (M + 16)x + 560x.
Theo bài: C% (MSO4) = 20% nên: ![]()
Từ đây ta tìm được M = 24 (magie). Oxit kim loại cần tìm là MgO

\(n_{MO}=\frac{m}{M}=\frac{a}{M+16}\left(mol\right)\)
\(PTHH:MO+H_2SO_4\rightarrow MSO_4+H_2O\)
\(\Rightarrow n_{H_2SO_4}=n_{MO}=n_{MSO_4}=\frac{a}{M+16}\left(mol\right)\\ \Rightarrow\left\{{}\begin{matrix}m_{H_2SO_4}=n.M=\left(\frac{a}{M+16}\right).98\left(g\right)\Rightarrow m_{ddH_2SO_4}=\frac{\left(\frac{a}{M+16}\right).98.100\%}{17,5\%}=560\left(\frac{a}{M+16}\right)\left(g\right)\\m_{MSO_4}=n.M=\left(\frac{a}{M+16}\right).\left(M+96\right)\left(g\right)\end{matrix}\right.\)
\(pt:C\%_{ddM}=\frac{m_{MSO_4}}{m_{ddspu}}.100\%=20\%\\ \Leftrightarrow\frac{\left(\frac{a}{M+16}\right)\left(M+96\right)}{a+560\left(\frac{a}{M+16}\right)}.100\%=20\%\\ ...................\\ \Leftrightarrow M=24a\\ Vs.a=1\Rightarrow M=24\left(TM\right)\\ \Rightarrow M:Mg\left(Magie\right)\\ \rightarrow CT.Oxit:MgO\)

- Giả sử khối lượng dung dịch axit là 100 g .
=> nH2SO4 = 0,05 ( mol )
\(R_2O_n+nH_2SO_4\rightarrow R_2\left(SO_4\right)_n+nH_2O\)
.0,05/n......0,05.............0,05/n.......0,05.............
=> mddsau = \(100+\dfrac{0,05}{n}\left(2R+16n\right)=100,8+\dfrac{R}{10n}\left(g\right)\)
=> \(5,882\%=\dfrac{\dfrac{0,05}{n}\left(2R+96n\right)}{100,8+\dfrac{R}{10n}}.100\%\)
=> \(R=11,99617501n\)
Lập bảng giá trị ta được : ( R; n ) = ( ~24; 2 ) TM .
Vậy công thức oxit là MgO .

Giả sử có 1 mol RCO3
PTHH: RCO3 + 2HCl → RCl2 + CO2↑ + H2O
1 → 2 1 1 1 (mol)
Ta có mdd(sau pứ) = mRCO3+mdd(HCl)−mCO2
⟹ mdd(sau pứ) = \(\dfrac{\text{MR+60+(2.36,5.100%)}}{7,3\%-1,44}\)=MR+1016
⟹ C%(RCl2)=mRCl2mdd(sau).100%=\(\dfrac{M_{R_{ }}+71}{_{ }M_R+1016}\).100%=9,135%
⟹ MR = 24 (Mg)
Vậy công thức của muối là MgCO3.

Đáp án A.
Coi nH2SO4 = 1 mol
M(OH)2 + H2SO4 → MSO4 + 2H2O
mdd H2SO4= 1.98.100/20 = 490 (gam)
=> mdd sau = (M + 34) + 490 = M + 524


Câu 5
Gọi kim loại là M, oxit là MO
Giả sử có 1 mol MO phản ứng, 1 mol H2SO4 phản ứng:
MO + H2SO4 -> MSO4 + H2O
C% = \(\frac{m_{ct}}{m_{dd}}\) . 100%
10% = \(\frac{98}{mdd}\) . 100%
-> mDd H2SO4 = 980 g
Theo định luật bảo toàn khối lượng ta có:
Mdd = mMO + mddH2SO4 = (M + 16) + 980
= M + 996
C%muối = m chất tan muối/ m dd muối . 100%
15.17% = (M + 96) / (M + 996) .100%
M = 64.95 g
M là Zn
Công thức oxit ZnO
#tham khảo nhưng mình đã sửa lại cho dễ hiểu rồi nhé
Câu 4:
\(\text{Gọi công thức chung của 2 kim loại kiềm là X}\)
\(\text{=> ct muối là X2CO3}\)
\(\text{X2CO3 + 2HCl -> 2XCl + CO2 + H2O}\)
-> n X2CO3 = n CO2 = 0.2
Công thức tính khối lượng : M = m/n Hay 2X + 60 = 18 : 0.2
-> X =15
\(\text{Bài dựa vào bth tìm 2 nguyên tố có ntk gần 15 là đc}\)

giả sử ban đầu có 98g dung dịch H2SO4. Gọi a là số mol của H2SO4
Ta có 10% = 98a.100%/98
=> số mol H2SO4: a = 0,1.
ptpu: MO + H2SO4 ---------------> MSO4 + H2O
0,1 0,1 0,1
Ta có: 11,8 = 0,1.(M + 98).100/[98+(16+M).0,1] => M=24 (Mg)
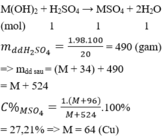
Giả sử số mol của MO là 1 mol
Pt: \(MO+H_2SO_4\rightarrow MSO_4+H_2O\)
1 ----------> 1---------> 1 -----------> 1
\(m_{dd\left(spu\right)}=M+16+\dfrac{98.100}{17,5}=M+576\left(g\right)\)
\(C\%_{MSO_4}=\dfrac{M+96}{M+576}.100=20\%\)
=> M = 24 => M là Mg