Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a, Ta có: \(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
PT: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
Theo PT: \(n_{FeSO_4}=n_{Fe}=0,1\left(mol\right)\Rightarrow m_{FeSO_4}=0,1.152=15,2\left(g\right)\)
b, \(n_{H_2}=n_{Fe}=0,1\left(mol\right)\Rightarrow V_{H_2}=0,1.22,4=2,24\left(l\right)\)
c, Sửa đề: 500 ml → 500 (g)
Theo PT: \(n_{H_2SO_4}=n_{Fe}=0,1\left(mol\right)\Rightarrow C\%_{H_2SO_4}=\dfrac{0,1.98}{500}.100\%=1,96\%\)

nH2=0,15 mol
2Al+3H2SO4=>Al2(SO4)3+3H2
0,1 mol<= 0,15 mol
mAl=0,1.27=2,7g
nAl2(SO4)3=0,05 mol
=>mAl2(SO4)3=342.0,05=17,1g
nH2SO4=0,15 mol=>mH2SO4=14,7
mdd H2SO4=14,7/10%=147g
mdd sau pứ=2,7+147-0,15.2=149,4g
C%dd Al2(SO4)3=17,1/149,4.100%=11,45%

a, \(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
\(n_{H_2SO_4}=0,2.1,35=0,27\left(mol\right)\)
PT: \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
Xét tỉ lệ: \(\dfrac{0,2}{2}>\dfrac{0,27}{3}\), ta được Al dư.
Theo PT: \(n_{H_2}=n_{H_2SO_4}=0,27\left(mol\right)\Rightarrow V_{H_2}=0,27.22,4=6,048\left(l\right)\)
b, \(n_{Al\left(pư\right)}=\dfrac{2}{3}n_{H_2SO_4}=0,18\left(mol\right)\)
\(\Rightarrow m_{Al\left(pư\right)}=0,18.27=4,86\left(g\right)\)
c, \(n_{Al_2\left(SO_4\right)_3}=\dfrac{1}{3}n_{H_2SO_4}=0,09\left(mol\right)\)
\(\Rightarrow C_{M_{Al_2\left(SO_4\right)_3}}=\dfrac{0,09}{0,2}=0,45\left(M\right)\)

n hh khí = 0.5 mol
nCO: x mol
nCO2: y mol
=> x + y = 0.5
28x + 44y = 17.2 g
=> x = 0.3 mol
y = 0.2 mol
Khối lượng oxi tham gia pứ oxh khử oxit KL: 0.2 * 16 = 3.2g => m KL = 11.6 - 3.2 = 8.4g
TH: KL hóa trị I => nKL = 2*nH2 = 0.3 mol => KL: 28!!
KL hóa trị III => nKL = 2/3 *nH2 = 0.1 mol => KL: 84!!
KL hóa trị II => nKL = nH2 = 0.15 mol => KL: 56 => Fe.
nFe / Oxit = 0.15 mol
nO/Oxit = 0.2 mol
=> nFe/nO = 3/4 => Fe3O4
Fe3O4 + 4CO = 3Fe + 4CO2
Fe + H2SO4 = FeSO4 + H2
0.15.....0.15.......0.15.....0.15
=> mH2SO4 pứ = 14.7 g => mdd = 147 g
m dd sau khi cho KL vào = m KL + m dd - mH2 thoát ra = 0.15 * 56 + 147 - 0.15*2 = 155.1g
=> C% FeSO4 = 14.7%

a, \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
b, \(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
Theo PT: \(n_{H_2SO_4}=n_{Fe}=0,2\left(mol\right)\Rightarrow m_{H_2SO_4}=0,2.98=19,6\left(g\right)\)
c, \(C\%_{H_2SO_4}=\dfrac{19,6}{50}.100\%=39,2\%\)
d, Theo PT: \(n_{H_2}=n_{Fe}=0,2\left(mol\right)\Rightarrow V_{H_2}=0,2.22,4=4,48\left(l\right)\)

PTHH: 2Na+2H2O=>2 NaOH+H2
nH2SO4=0,2mol
PTHH: 2NaOH+H2SO4=> Na2SO4+2H2O
0,4mol<-0,2mol
=> n NaOH=0,4mol
mà nNaOH=nNa=0,4mol
=> m Na =0,4.23=9,2g
nH2=1/2nNaOH=1/2.0,2=0,1mol
=> V H2=0,1.22,4=2,24ml

PTHH: \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\uparrow\)
Ta có: \(\left\{{}\begin{matrix}n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\\n_{H_2SO_4}=\dfrac{200\cdot29,4\%}{98}=0,6\left(mol\right)\end{matrix}\right.\)
Xét tỉ lệ: \(\dfrac{0,2}{2}< \dfrac{0,6}{3}\) \(\Rightarrow\) Axit còn dư, Nhôm p/ứ hết
\(\Rightarrow\left\{{}\begin{matrix}n_{Al_2\left(SO_4\right)_3}=0,1\left(mol\right)\\n_{H_2}=0,3\left(mol\right)\\n_{H_2SO_4\left(dư\right)}=0,6-0,3=0,3\left(mol\right)\end{matrix}\right.\)\(\Rightarrow\left\{{}\begin{matrix}m_{Al_2\left(SO_4\right)_3}=0,1\cdot342=34,2\left(g\right)\\m_{H_2SO_4\left(dư\right)}=0,3\cdot98=29,4\left(g\right)\\m_{H_2}=0,3\cdot2=0,6\left(g\right)\\V_{H_2}=0,3\cdot22,4=6,72 \left(l\right)\end{matrix}\right.\)
Mặt khác: \(m_{dd\left(saup/ứ\right)}=m_{Al}+m_{ddH_2SO_4}-m_{H_2}=204,8\left(g\right)\)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{Al_2\left(SO_4\right)_3}=\dfrac{34,2}{204,8}\cdot100\%\approx16,7\%\\C\%_{H_2SO_4\left(dư\right)}=\dfrac{29,4}{204,8}\cdot100\%\approx14,36\%\end{matrix}\right.\)

Bước 1 — Viết phương trình phản ứng
\(\text{Ba} + \text{H}_{2} \text{SO}_{4} \rightarrow \text{BaSO}_{4} \downarrow + \text{H}_{2} \uparrow\) \(2 \text{Al} + 3 \text{H}_{2} \text{SO}_{4} \rightarrow \text{Al}_{2} \left(\right. \text{SO}_{4} \left.\right)_{3} + 3 \text{H}_{2} \uparrow\)
Lưu ý: BaSO₄ kết tủa, không tan, còn Al₂(SO₄)₃ tan.
Bước 2 — Tính số mol H₂ tạo ra
\(n_{H_{2}} = \frac{13 , 6345}{22 , 4} \approx 0 , 6092 \&\text{nbsp};\text{mol}\)
Bước 3 — Gọi ẩn số mol của Ba và Al
Gọi:
\(n_{B a} = x , n_{A l} = y\)
Từ các PTHH:
- 1 mol Ba → 1 mol H₂
- 2 mol Al → 3 mol H₂
⇒ Quan hệ:
\(x + \frac{3}{2} y = 0 , 6092 (\text{1})\)
Khối lượng hỗn hợp:
\(137 x + 27 y = 21 , 8 (\text{2})\)
Bước 4 — Giải hệ phương trình
Từ (1):
\(x = 0 , 6092 - 1 , 5 y\)
Thay vào (2):
\(137 \left(\right. 0 , 6092 - 1 , 5 y \left.\right) + 27 y = 21 , 8\)
Tính:
\(137 \times 0 , 6092 \approx 83 , 4604\) \(83 , 4604 - 205 , 5 y + 27 y = 21 , 8\) \(83 , 4604 - 178 , 5 y = 21 , 8\) \(- 178 , 5 y = 21 , 8 - 83 , 4604 = - 61 , 6604\) \(y = \frac{61 , 6604}{178 , 5} \approx 0 , 3455 \&\text{nbsp};\text{mol}\)
Tính \(x\):
\(x = 0 , 6092 - 1 , 5 \times 0 , 3455 \approx 0 , 6092 - 0 , 5183 = 0 , 0909 \&\text{nbsp};\text{mol}\)
Bước 5 — Thành phần % khối lượng
- \(m_{B a} = 0 , 0909 \times 137 \approx 12 , 45 \&\text{nbsp};\text{g}\)
- \(m_{A l} = 0 , 3455 \times 27 \approx 9 , 33 \&\text{nbsp};\text{g}\)
Kiểm tra: \(12 , 45 + 9 , 33 \approx 21 , 78 \approx 21 , 8\) ✔️
\(\% \text{Ba} = \frac{12 , 45}{21 , 8} \times 100 \% \approx 57 , 1 \%\) \(\% \text{Al} = \frac{9 , 33}{21 , 8} \times 100 \% \approx 42 , 9 \%\)
✅ Kết quả phần (a):
\(\boxed{\% B a \approx 57 , 1 \% , \% A l \approx 42 , 9 \%}\)
Bước 6 — Tính nồng độ % dung dịch thu được
Chất tan sau phản ứng:
- \(\text{BaSO}_{4}\) kết tủa, không tan
- \(\text{Al}_{2} \left(\right. \text{SO}_{4} \left.\right)_{3}\) tan trong dung dịch
- Dung dịch thu được: chỉ chứa \(\text{Al}_{2} \left(\right. \text{SO}_{4} \left.\right)_{3}\) và nước
Tính khối lượng muối \(\text{Al}_{2} \left(\right. \text{SO}_{4} \left.\right)_{3}\)
- \(2 \text{Al} \rightarrow 1 \text{Al}_{2} \left(\right. \text{SO}_{4} \left.\right)_{3}\)
Số mol:
\(n_{\text{Al}_{2} \left(\right. \text{SO}_{4} \left.\right)_{3}} = \frac{0 , 3455}{2} \approx 0 , 17275 \&\text{nbsp};\text{mol}\)
Khối lượng mol:
\(M \left(\right. \text{Al}_{2} \left(\right. \text{SO}_{4} \left.\right)_{3} \left.\right) = 2 \times 27 + 3 \times \left(\right. 32 + 4 \times 16 \left.\right) = 54 + 3 \times 96 = 54 + 288 = 342 \&\text{nbsp};\text{g}/\text{mol}\)
Khối lượng:
\(m = 0 , 17275 \times 342 \approx 59 , 1 \&\text{nbsp};\text{g}\)
Tính khối lượng dung dịch sau phản ứng
Khối lượng các chất ban đầu:
- Kim loại: \(21 , 8 \&\text{nbsp};\text{g}\)
- Dung dịch \(H_{2} S O_{4}\) 9,8%: gọi khối lượng \(m_{d d}\)
Ta cần tính \(m_{d d}\):
Gọi số mol \(H_{2} S O_{4}\):
\(\text{v}ớ\text{i}\&\text{nbsp};\text{Ba}:\&\text{nbsp}; x = 0 , 0909 \&\text{nbsp};\text{mol}\&\text{nbsp};\text{d} \overset{ˋ}{\text{u}} \text{ng}\&\text{nbsp}; 0 , 0909 \&\text{nbsp};\text{mol}\&\text{nbsp}; H_{2} S O_{4}\) \(\text{v}ớ\text{i}\&\text{nbsp};\text{Al}:\&\text{nbsp}; y = 0 , 3455 \&\text{nbsp};\text{mol}\&\text{nbsp};\text{d} \overset{ˋ}{\text{u}} \text{ng}\&\text{nbsp}; \frac{3}{2} \times 0 , 3455 = 0 , 5183 \&\text{nbsp};\text{mol}\&\text{nbsp}; H_{2} S O_{4}\)
Tổng:
\(n_{H_{2} S O_{4}} = 0 , 0909 + 0 , 5183 = 0 , 6092 \&\text{nbsp};\text{mol}\)
Khối lượng:
\(m_{H_{2} S O_{4}} = 0 , 6092 \times 98 \approx 59 , 7 \&\text{nbsp};\text{g}\)
Vì \(H_{2} S O_{4}\) chiếm 9,8% trong dung dịch:
\(m_{d d} = \frac{59 , 7}{0 , 098} \approx 609 , 2 \&\text{nbsp};\text{g}\)
Khối lượng dung dịch sau phản ứng
Sau phản ứng, thoát khí \(H_{2}\) và tách kết tủa \(B a S O_{4}\):
- Khối lượng \(B a S O_{4}\):
\(0 , 0909 \times 233 \approx 21 , 2 \&\text{nbsp};\text{g}\)
Khối lượng dung dịch sau phản ứng:
\(m_{d d \&\text{nbsp}; s a u} = 21 , 8 + 609 , 2 - 13 , 6345 \times \frac{2}{22 , 4} - 21 , 2\)
Nhưng cẩn thận: khối lượng khí \(H_{2}\):
\(m_{H_{2}} = 0 , 6092 \times 2 \approx 1 , 22 \&\text{nbsp};\text{g}\)
Vậy:
\(m_{d d \&\text{nbsp}; s a u} = 21 , 8 + 609 , 2 - 21 , 2 - 1 , 22 \approx 608 , 58 \&\text{nbsp};\text{g}\)
Tính nồng độ %
\(C \% = \frac{59 , 1}{608 , 58} \times 100 \% \approx 9 , 7 \%\)
✅ Kết quả cuối cùng
- (a) \(\boxed{\%Ba\approx57,1\%,;\%Al\approx42,9\%}\)
- (b) \(\boxed{C \% \left(\right. \text{Al}_{2} \left(\right. \text{SO}_{4} \left.\right)_{3} \left.\right) \approx 9 , 7 \%}\)
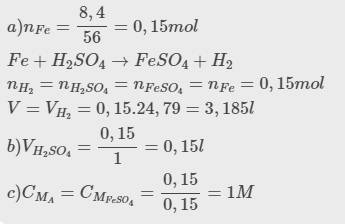
\(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
PT: \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
Theo PT: \(n_{H_2}=\dfrac{3}{2}n_{Al}=0,3\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,3.24,79=7,437\left(l\right)\)
\(n_{Al}=\dfrac{5,4}{27}=0,2mol\\ 2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\\ n_{H_2}=1,5.0,2=0,3mol\\ V_{H_2}=0,3.24,79=7,437l\)