Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi nNO = nNO2 = a (mol)
\(n_{Cu}=\dfrac{2,56}{64}=0,04\left(mol\right)\)
Cu0 - 2e --> Cu+2
0,04->0,08
N+5 + 3e --> N+2
3a<---a
N+5 + 1e --> N+4
a<---a
Bảo toàn e: 4a = 0,08
=> a = 0,02 (mol)
=> V = (0,02 + 0,02).22,4 = 0,896 (l)

Coi hh X gồm Fe, Cu và O
Đặt \(n_{Fe\left(Fe_xO_y\right)}=a;n_{Cu}=b;n_{O\left(Fe_xO_y\right)}=c\) ( mol )
\(\Rightarrow m_{hh}=56a+64b+16c=14,64\left(g\right)\) (1)
\(m_{muối}=m_{Fe\left(NO_3\right)_3}+m_{Cu\left(NO_3\right)_2}=242a+188b=47,58\left(g\right)\) (2)
Bảo toàn e: \(3n_{Fe}+2n_{Cu}=2n_O+3n_{NO}=3a+2b=2c+3.0,09\) (3)
\(\left(1\right);\left(2\right);\left(3\right)\Rightarrow\left\{{}\begin{matrix}a=0,15\\b=0,06\\c=0,15\end{matrix}\right.\)
\(\%m_{Cu}=\dfrac{0,06.64}{14,64}.100=26,22\%\)
\(\dfrac{x}{y}=\dfrac{0,15}{0,15}=\dfrac{1}{1}\Rightarrow CTHH:FeO\)

Chất rắn gồm : Ag,Cu dư
\(n_{Ag} = n_{AgNO_3} = 0,1(mol)\\ \Rightarrow n_{Cu} = \dfrac{15,92-0,1.108}{64} = 0,08(mol)\)
Gọi \(n_{Cu} = n_{Fe} = a(mol)\)
Dung dịch sau phản ứng :
\(Fe^{2+} : a + 0,14\\ Cu^{2+} : a - 0,08\\ NO_3^- : 0,1 + 0,14.3 = 0,52(mol)\)
Bảo toàn điện tích : 2(a+0,14) + 2(a -0,08) = 0,52
⇒ a = 0,1
Vậy \(n_{Fe^{2+}} = a + 0,14 = 0,24(mol)\)
Bảo toàn e :
\(n_{Fe^{2+}} = 3n_{NO}\\ \Rightarrow n_{NO} = \dfrac{0,24}{3} = 0,08(mol)\\ \Rightarrow V = 0,08.22,4 = 1,792(lít)\)
Đáp án C

Theo gt ta có: $n_{NO}=0,104(mol);n_{NO_2}=0,416(mol)$
Mặt khác $n_{Fe_2O_3}=0,025(mol)\Rightarrow n_{Fe/Y}=0,1(mol)$
Gọi số mol Cu và Ag lần lượt là a;b
$\Rightarrow 64a+108b=9,128.2$
Bảo toàn e ta có: $2a+b=0,428$
Giải hệ ta được $a=0,184;b=0,06$
Bạn kiểm tra đề có thời gian không nhé. Có thì áp dụng \(n_e=\dfrac{I.t}{96500}\) (Công thức Faraday thu gọn) rồi tính được I nhé
Cho em hỏi là 4g đấy là Fe2O3, nhưng mà còn CuO đâu ạ? Có thể giải thích lại cho em được không ạ?

Đáp án C.
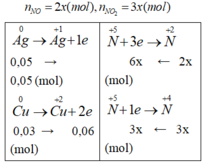
9x = 0,11; x= 11/900 => V = 5x.22,4 = 1,368 (l)

Gọi số mol của kim loại Fe có trong hỗn hợp trên là \(x\) (mol) \(\Rightarrow n_{Cu}=2x\left(mol\right)\) (Vì \(n_{Fe}:n_{Cu}=1:2\))
Theo đề, ta có: mhỗn hợp = \(m_{Fe}+m_{Cu}=56x+64.2x=18,4\left(g\right)\)
\(\Leftrightarrow x=0,1\left(mol\right)\)
Vậy, trong hỗn hợp ban đầu có 0,1 (mol) Fe và 0,2 (mol) Cu.
PTHH:
\(Fe+6HNO_3\rightarrow Fe\left(NO_3\right)_3+3NO_2+3H_2O\left(1\right)\)
Số mol: 0,1 mol -------------------------------> 0,3 mol
\(Cu+4HNO_3\rightarrow Cu\left(NO_3\right)_2+2NO_2+2H_2O\left(2\right)\)
Số mol: 0,2 mol ---------------------------------> 0,4 mol
Theo (1), ta có: \(n_{NO_2\left(1\right)}=3n_{Fe}=3.0,1=0,3\left(mol\right)\)
Theo (2), ta có: \(n_{NO_2\left(2\right)}=2.n_{Cu}=2.0,2=0,4\left(mol\right)\)
\(\Rightarrow\sum n_{NO_2}=n_{NO_2\left(1\right)}+n_{NO_2\left(2\right)}=0,3+0,4=0,7\left(mol\right)\)
\(\Rightarrow V_{NO_2}=0,7.22,4=15,68\left(l\right)\)