Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
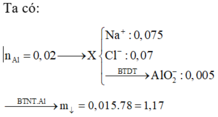
nAl = 0,02 mol; nCl– = 0,07 mol; nNa+ = 0,075 mol.
Ghép NaCl
⇒ còn dư (0,075 – 0,07 = 0,005) mol Na+
⇒ ghép với AlO2– tạo NaAlO2.
||⇒ ghép được 0,005 mol NaAlO2 và còn dư (0,02 – 0,005 = 0,015) mol nguyên tố Al.
► Dùng nguyên tố đó ghép vào ↓ ⇒ nAl(OH)3 = 0,015 mol
⇒ m = 1,17(g)

Giải thích:
nAl = 0,02 mol
nHCl = 0,07 mol
nNaOH = 0,075 mol
Al + 3HCl → AlCl3 + 1,5H2
Bđ: 0,02 0,07
Pư: 0,02 0,06 0,02
Sau: 0 0,01 0,02
Vậy dung dịch X gồm: Al3+ (0,02 mol) và H+ dư (0,01 mol)
Khi cho 0,075 mol NaOH vào dd X:
H+ + OH- → H2O
0,01 0,01
Al3+ + 3OH- → Al(OH)3
0,02 0,06 0,02
Al(OH)3 + OH- → AlO2- + 2H2O
0,005←0,005
Vậy khối lượng Al(OH)3: m = (0,02-0,005).78 = 1,17 gam
Đáp án B

Đáp án B
nAl = 0,02 mol
nHCl = 0,07 mol
nNaOH = 0,075 mol
Al + 3HCl → AlCl3 + 1,5H2
Bđ: 0,02 0,07
Pư: 0,02 0,06 0,02
Sau: 0 0,01 0,02
Vậy dung dịch X gồm: Al3+ (0,02 mol) và H+ dư (0,01 mol)
Khi cho 0,075 mol NaOH vào dd X:
H+ + OH- → H2O
0,01 0,01
Al3+ + 3OH- → Al(OH)3
0,02 0,06 0,02
Al(OH)3 + OH- → AlO2- + 2H2O
0,005←0,005
Vậy khối lượng Al(OH)3:
m = (0,02-0,005).78 = 1,17 gam

Đáp án D
nAl = 0,02 mol; nCl– = 0,07 mol; nNa+ = 0,075 mol. Ghép NaCl
⇒ còn dư (0,075 – 0,07 = 0,005) mol Na+ ⇒ ghép với AlO2– tạo NaAlO2.
⇒ ghép được 0,005 mol NaAlO2 và còn dư (0,02 – 0,005 = 0,015) mol nguyên tố Al.
► Dùng nguyên tố đó ghép vào ↓ ⇒ nAl(OH)3 = 0,015 mol ⇒ m = 1,17(g)

Giải thích:
nAl = 0,54: 27 = 0,02 (mol) ; nHCl = 0,07 (mol) ; nNaOH = 0,075 (mol)

Khi cho NaOH vào dd X thì phản ứng trung hòa xảy ra trước:
H+ + OH- → H2O
0,01 →0,01
=> nNaOH tác dụng với Al3+ = 0,075 – 0,01 = 0,065 (mol)
=> Bài toán quy về dạng cho dd kiềm tác dụng với muối Al
Ta có: 
=> Tạo Al(OH)3 và AlO2 –
=> nAl(OH)3 = 4nAl3+ - nOH- = 4. 0,02 – 0,065 = 0,015 (mol)
=> mAl(OH)3 = 0,015.78 = 1,17 (g)
Đáp án D

Đáp án A
Từ giả thiết suy ra : Ở TN2 đã có hiện tượng hòa tan kết tủa. Còn ở TN1 thì có thể có hiện tượng hòa tan kết tủa hoặc chưa. Ta đặt :
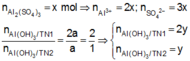
● Nếu cả TN1 và TN2 đều có hiện tượng hòa tan kết tủa, áp dụng bảo toàn điện tích cho các dung dịch sau phản ứng, ta có :
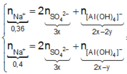
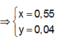
![]() thỏa mãn
thỏa mãn
Suy ra : ![]()
● Nếu TN1 chưa có hiện tượng hòa tan kết tủa, áp dụng bảo toàn điện tích cho các dung dịch sau phản ứng, ta có :
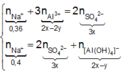
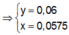
![]() (loại)
(loại)

Đáp án A
![]()
![]()
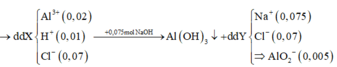
( Sau phản ứng thu được kết tủa, nên trong dung dịch Y không còn ion H + hoặc ion O H - ;
bảo toàn điện tích
=> trong dung dịch Y có ion A l O 2 - ( 0 , 005 )
![]()
⇒ m A l ( O H ) 3 = 0 , 015 . 78 = 1 , 17
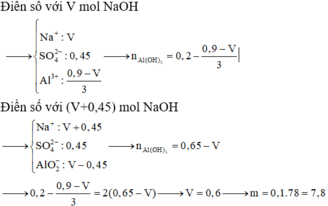
Đáp án B
nAl = 0,02 mol
nHCl = 0,07 mol
nNaOH = 0,075 mol
Al + 3HCl → AlCl3 + 1,5H2
Bđ: 0,02 0,07
Pư: 0,02 0,06 0,02
Sau: 0 0,01 0,02
Vậy dung dịch X gồm: Al3+ (0,02 mol) và H+ dư (0,01 mol)
Khi cho 0,075 mol NaOH vào dd X:
H+ + OH- → H2O
0,01 0,01
Al3+ + 3OH- → Al(OH)3
0,02 0,06 0,02
Al(OH)3 + OH- → AlO2- + 2H2O
0,005←0,005
Vậy khối lượng Al(OH)3: m = (0,02-0,005).78 = 1,17 gam