Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
Áp dụng định luật bảo toàn mol electron, ta có:
Mà n N O 2 = 3 n H 2 n ê n n e n h ư ờ n g ( 1 ) = n N O 2 n e n h ư ờ n g ( 2 ) = 2 n H 2
Nên ne nhường(1) =3/2 ne nhường(2)
Do đó số mol electron trao đổi ở hai trường hợp là không giống nhau nên R là kim loại có nhiều hóa trị.
Mà kim loại có hóa trị I, II hoặc III.
Kết hợp với
n e n h ư ờ n g ( 1 ) n e n h ư ờ n g ( 2 ) = n R . h o a t r i 1 n p . h o a t r i 2 = 3 2
Ta được R có hóa trị II và III (trong đó R thể hiện hóa trị II khi tác dụng với dung dịch H2SO4 loãng và thể hiện hóa trị III khi tác dụng với dung dịch HNO3 đặc nóng).
Chọn 3 mol R đem hòa tan ban đầu. Khi đó ở các lần thí nghiệm ta thu được 3 mol R(NO3)3 và 3 mol RSO4.
Theo giả thiết ta có:
m R S O 4 = 62 , 81 % m R ( N O 3 ) 2
hay R + 96 = 62,81%(R +186)ÛR = 56ÞR là Fe.
Khi đó, áp dụng định luật bảo toàn moi electron ta có số mol NO2 tạo thành là: n NO2= 3nFe=9
Khi đó lượng oxi đã sử dụng là 9.22,22% = 2
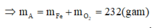
A sẽ chứa một hoặc một số oxit của Fe. Để đơn giản cho quá trình tính toán, coi A là hỗn hợp chứa 3 mol Fe và 4 mol O.
Khi đó trong 20,88 gam A (20,88 = 0,09.232) có 0,27 mol Fe và 0,36 mol O.
nB = 0,03.
Gọi n là số mol electron mà x mol nguyên tử nhận để thu được 1 mol NxOy
Áp dụng định luật bảo toàn mol electron, ta có:
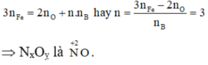
Khi đó:

a) Thể tích nước cần dùng để pha loãng.
Khối lượng của 100ml dung dịch axit 98%
100ml × 1,84 g/ml = 184g
Khối lượng H2SO4 nguyên chất trong 100ml dung dịch trên
Khối lượng dung dịch axit 20% có chứa 180,32g H2SO4 nguyên chất.
Khối lượng nước cần bổ sung vào 100ml dung dịch H2SO4 98% để có được dung dịch 20%.
901,6g – 184g = 717,6g
Vì D của nước là 1 g/ml nên thể tích nước cần bổ sung là 717,6 ml.
b) Cách tiến hành khi pha loãng
Khi pha loãng lấy 717,6 ml H2O vào ống đong hình trụ có thể tích khoảng 2 lít. Sau đó cho từ từ 100ml H2SO4 98% vào lượng nước trên, đổ axit chảy theo một đũa thủy tinh, sau khi đổ vài giọt nên dùng đũa thủy tinh khuấy nhẹ đều. Không được đổ nước vào axit 98%, axit sẽ bắn vào da, mắt ... và gây bỏng rất nặng
a) Thể tích nước cần dùng để pha loãng.
Khối lượng của 100ml dung dịch axit 98%
100ml × 1,84 g/ml = 184g
Khối lượng H2SO4 nguyên chất trong 100ml dung dịch trên
Khối lượng dung dịch axit 20% có chứa 180,32g H2SO4 nguyên chất.
Khối lượng nước cần bổ sung vào 100ml dung dịch H2SO4 98% để có được dung dịch 20%.
901,6g – 184g = 717,6g
Vì D của nước là 1 g/ml nên thể tích nước cần bổ sung là 717,6 ml.
b) Cách tiến hành khi pha loãng
Khi pha loãng lấy 717,6 ml H2O vào ống đong hình trụ có thể tích khoảng 2 lít. Sau đó cho từ từ 100ml H2SO4 98% vào lượng nước trên, đổ axit chảy theo một đũa thủy tinh, sau khi đổ vài giọt nên dùng đũa thủy tinh khuấy nhẹ đều. Không được đổ nước vào axit 98%, axit sẽ bắn vào da, mắt ... và gây bỏng rất nặng

Bài này tương tự, tham khảo.
Hỗn hợp A gồm oxit của một kim loại hoá trị II và muối cacbonat của kim loại đó được hoà tan hết bằng axit HCl vừa đủ tạo ra khí B và còn dung dịch D. Đem cô cạn D thu được một lượng muối khan bằng 168% lượng A. Biết khối lượng khí B bằng 44% lượng A. Hỏi kim loại hoá trị II nói trên là nguyên tố nào ? % lượng mỗi chất trong A bằng bao nhiêu.
Bài làm
Gọi kim loại hóa trị II là R, có nguyên tử khối là R (R > 0), x là số mol của RO (x > 0)
Theo bài ra ta có các PTHH :
RO + H2SO4 \(\rightarrow\) RSO4 + H2O
RCO3 + H2SO4 \(\rightarrow\) RSO4 + CO2\(\uparrow\) + H2O
Giả sử khối lượng của A đem tham gia p.ứng là 100g thì khối lượng RSO4 = 168g và khối lượng CO2 = 44g \(\approx\) 1 mol.
Theo giả sử ta có : (R + 16)x + R + 60 = 100 (1)
Theo phương trình ta có : (R + 96)x + R + 96 = 168 (2)
Từ (1), (2) \(\Rightarrow\) x = 0,4
R \(\approx\) 24 \(\Rightarrow\) Mg
Phần trăm khối lượng của oxit là : %MgO = 16%
Phần trăm khối lượng của muối là : %MgCO3 = 84%
chép mạng . Không tính. Mới có lớp 7 làm sao nổi hóa lớp 8 chứ không ns đến lớp 10

nMg=0,1(mol)
PT: Mg+2HCl--->MgCl2+H2
TPT: nH2=nMg=0,1(mol)
V\(_{H2}\)=2,24(l)
nMgCl2=nMg=0,1(mol)
mMgCl2=0,1.95=9,5(g)
Mik lm z nếu đề cho HCl dư thoy nhưng theo mik nghĩ có lẽ đề bạn gõ thiếu nồng độ mol của HCl bài này sẽ lq đến chất dư ( mik nghĩ z )

\(m_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PTHH: \(Mg+2H_2SO_4\rightarrow2MgSO_4+SO_2+H_2\)
________x________________________________x
PTHH: \(Cu+2H_2SO_4\rightarrow2CuSO_4+SO_2+H_2\)
_______y_________________________________y
Ta có hệ phương trình:
\(\left\{{}\begin{matrix}24x+64y=11,2\\x+y=0,3\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,2\\y=0,1\end{matrix}\right.\)
\(\%Mg=\dfrac{0,2.24}{11,2}.100\%\simeq42,85\%\)
\(\Rightarrow\%Cu=100\%-42,85\%=57,15\%\)
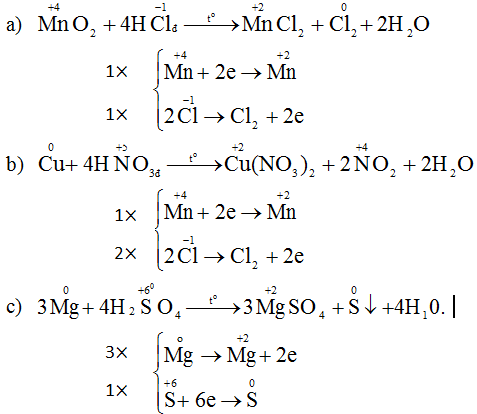
Đáp án C
Áp dụng định luật bảo toàn mol electron, ta có:
Mà nên
Nên ne nhường(1) = ne nhường(2)
Do đó số mol electron trao đổi ở hai trường hợp là không giống nhau nên R là kim loại có nhiều hóa trị.
Mà kim loại có hóa trị I, II hoặc III.
Kết hợp với
Ta được R có hóa trị II và III (trong đó R thể hiện hóa trị II khi tác dụng với dung dịch H2SO4 loãng và thể hiện hóa trị III khi tác dụng với dung dịch HNO3 đặc nóng).
Chọn 3 mol R đem hòa tan ban đầu. Khi đó ở các lần thí nghiệm ta thu được 3 mol R(NO3)3 và 3 mol RSO4.
Theo giả thiết ta có:
hay R + 96 = 62,81%(R +186)ÛR = 56ÞR là Fe.
Khi đó, áp dụng định luật bảo toàn moi electron ta có số mol NO2 tạo thành là:
Khi đó lượng oxi đã sử dụng là 9.22,22% = 2
A sẽ chứa một hoặc một số oxit của Fe. Để đơn giản cho quá trình tính toán, coi A là hỗn hợp chứa 3 mol Fe và 4 mol O.
Khi đó trong 20,88 gam A (20,88 = 0,09.232) có 0,27 mol Fe và 0,36 mol O.
nB = 0,03.
Gọi n là số mol electron mà x mol nguyên tử N + 5 nhận để thu được 1 mol NxOy
Áp dụng định luật bảo toàn mol electron, ta có:
Þ NxOỵ là .
Khi đó