Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{FeO}=\dfrac{14,4}{72}=0,2\left(mol\right)\)
\(m_{ct}=\dfrac{10,95.200}{100}=21,9\left(g\right)\)
\(n_{HCl}=\dfrac{21,9}{36,5}=0,6\left(mol\right)\)
Pt : \(FeO+2HCl\rightarrow FeCl_2+H_2O|\)
1 2 1 1
0,2 0,6 0,2
a) Lập tỉ số so sánh : \(\dfrac{0,2}{1}< \dfrac{0,6}{2}\)
⇒ FeO phản ứng hết , HCl dư
⇒ Tính toán dựa vào số mol của FeO
\(n_{HCl\left(dư\right)}=0,6-\left(0,2.2\right)=0,2\left(mol\right)\)
⇒ \(m_{HCl\left(dư\right)}=0,2.36,5=7,3\left(g\right)\)
b) \(n_{FeCl2}=\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
⇒ \(m_{FeCl2}=0,2.127=25,4\left(g\right)\)
\(m_{ddspu}=14,4+200=214,4\left(g\right)\)
\(C_{FeCl2}=\dfrac{25,4.100}{214,4}=11,85\)0/0
\(C_{HCl\left(dư\right)}=\dfrac{7,3.100}{214,4}=3,4\)0/0
Chúc bạn học tốt

bạn xem lại xem 13.5(g) hay 13.8g nhé ^^ ,cho tròn số ý mà
CuCl2+2NaOH->Cu(OH)2+2NaCl
nCuCl2=13.5:138=0.1(mol)
nNaOH=20:40=0.5(mol)
theo pthh:nNaOH=2nCuCl2
theo bài ra,nNaOH=5 nCuCl2->NaOH dư tính theo CuCl2
theo pthh,nCu(OH)2=nCuCl2->nCu(OH)2=0.1(mol)
mCu(OH)2=0.1*98=9.8(g)
b)PTHH:Cu(OH)2+2HCl->CuCl2+2H2O
theo pthh:nHCl=2nCu(OH)2->nHCl=0.1*2=0.2(mol)
mHCl=0.2*36.5=7.3(g)
mDD HCl=7.3*100:10=73(g)

Bài 1:
a) nP=6,2/31=0,2(mol); nO2= 6,72/22,4=0,3(mol)
PTHH: 4P + 5 O2 -to-> 2 P2O5
Ta có: 0,2/4 < 0,3/5
=> P hết, O2 dư, tính theo nP
=> nO2(p.ứ)= 5/4. nP= 5/4. 0,2=0,25(mol)
=> mO2(dư)=0,3- 0,25=0,05(mol)
=> mO2(dư)=0,05.32=1,6(g)
b) nP2O5= nP/2= 0,2/2=0,1(mol)
=>mP2O5=0,1.142=14,2(g)

\(a,PTHH:Zn+2HCl\rightarrow ZnCl_2+H_2\\ b,n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\\ n_{HCl}=2\cdot0,15=0,3\left(mol\right)\)
Vì \(\dfrac{n_{Zn}}{1}>\dfrac{n_{HCl}}{2}\) nên sau p/ứ Zn dư
\(\Rightarrow n_{Zn}=\dfrac{1}{2}n_{HCl}=0,15\left(mol\right)\\ \Rightarrow m_{Zn}=0,15\cdot65=9,75\\ \Rightarrow m_{Zn\left(dư\right)}=13-9,75=3,25\left(g\right)\\ c,n_{H_2}=n_{Zn}=0,15\left(mol\right)\\ \Rightarrow V_{H_2}=0,15\cdot22,4=3,36\left(l\right)\)

(a) Gọi CTPT của các chất là CxHyOz
M<170 => mC<170.55,8% => 12x<94,86 => x<7,9
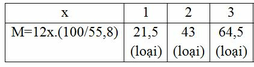
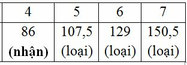
Vậy CTPT có dạng: C4HyOz (y≤10)(Do M là các số nguyên và là số chẵn)
Ta có: 12.4 + y + 16z = 86 => y + 16z = 38
+ z = 1: y = 22 (loại)
+ z = 2: y = 6 (nhận)
Vậy CTPT của các chất là: C4H6O2
b) A, B đều có nhóm CH3 và phản ứng với NaHCO3 tạo khí và chỉ có B có đồng phân hình học nên cấu tạo của A và B là:
A: CH2=C(CH3)-COOH
B: CH3-CH=CH-COOH
F, H, K có phản ứng với NaHCO3 tạo khí nên F, H, K là các axit.
- G là hợp chất không bền và chuyển hóa ngay thành G’ (G và G’ có cùng công thức phân tử) và khi oxy hóa bằng H2CrO4, hợp chất G’ chuyển hóa thành F nên G’ và F có cùng số nguyên tử C
C: CH3COOCH=CH2
F: CH3COOH
G: CH2=CH-OH
G’: CH3CHO
- H có phản ứng với NaHCO3 tạo khí nên H là axit. Mặt khác, phản ứng của H với bạc nitrat trong amoniac chỉ tạo thành các chất vô cơ nên H là HCOOH
D: HCOOCH2-CH=CH2
H: HCOOH
I: CH2=CH-CH2-OH
- L bị oxi hóa tạo HCOOH nên L là CH3OH
E: CH2=CH-COOCH3
K: CH2=CH-COOH
L: CH3OH
(1) CH2=C(CH3)-COOH (A) + NaHCO3 → CH2=C(CH3)-COONa + H2O + CO2
(2) CH3-CH=CH-COOH (B) + NaHCO3 → CH3-CH=CH-COONa + H2O + CO2
(3) CH3COOCH=CH2 (C) + NaOH → CH3COONa + CH3CHO (G’)
(4) CH3COONa + HCl → CH3COOH (F) + NaCl
(5) HCOOCH2-CH=CH2 (D) + NaOH → HCOONa + CH2=CH-CH2-OH (I)
(6) HCOONa + HCl → HCOOH (H) + NaCl
(7) CH2=CH-COOCH3 (E) + NaOH → CH2=CH-COONa + CH3OH (L)
(8) CH2=CH-COONa + HCl → CH2=CH-COOH (K) + NaCl
(9) CH3CHO + H2CrO4 → CH3COOH + H2CrO3
(10) CH3OH + 2H2CrO4 → HCOOH + 2H2CrO3 + H2O
(11) HCOOH + 2AgNO3 + 4NH3 + H2O → (NH4)2CO3 + 2Ag + 2NH4NO3
(c) Phản ứng polime hóa của A và C:
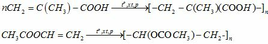
(d)


a. PTHH:
\(BaO+2HCl--->BaCl_2+H_2O\left(1\right)\)
\(BaCO_3+2HCl--->BaCl_2+CO_2\uparrow+H_2O\left(2\right)\)
Ta có: \(n_{CO_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Theo PT(2): \(n_{BaCO_3}=n_{CO_2}=0,2\left(mol\right)\)
\(\Rightarrow m_{BaCO_3}=0,2.197=39,4\left(g\right)\)
\(\Rightarrow\%_{m_{BaCO_3}}=\dfrac{39,4}{54,7}.100\%=72,03\%\)
\(\%_{m_{BaO}}=100\%-72,03\%=27,97\%\)
b. Ta có: \(m_{BaO}=54,7-39,4=15,3\left(g\right)\)
\(\Rightarrow n_{BaO}=\dfrac{15,3}{153}=0,1\left(mol\right)\)
\(\Rightarrow n_A=0,1+0,2=0,3\left(mol\right)\)
Theo PT(1,2): \(n_{HCl}=2.n_A=2.0,3=0,6\left(mol\right)\)
\(\Rightarrow m_{HCl}=0,6.36,5=21,9\left(g\right)\)
Ta có: \(C_{\%_{HCl}}=\dfrac{21,9}{m_{dd_{HCl}}}.100\%=20\%\)
\(\Rightarrow m_{dd_{HCl}}=109,5\left(g\right)\)
\(n_{CO2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
a) Pt : \(BaO+2HCl\rightarrow BaCl_2+H_2O|\)
1 2 1 1
0,1 0,2
\(BaCO_3+2HCl\rightarrow BaCl_2+CO_2+H_2O|\)
1 2 1 1 1
0,2 0,4 0,2
\(n_{BaCO3}=\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
\(m_{BaCO3}=0,2.197=39,4\left(g\right)\)
\(m_{BaO}=54,7-39,4=15,3\left(g\right)\)
0/0BaO = \(\dfrac{15,3.100}{54,7}=27,97\)0/0
0/0BaCO3 = \(\dfrac{39,4.100}{54,7}=72,03\)0/0
b) Có : \(m_{BaO}=15,3\left(g\right)\)
\(n_{BaO}=\dfrac{15,3}{153}=0,1\left(mol\right)\)
\(n_{HCl\left(tổng\right)}=0,2+0,4=0,6\left(mol\right)\)
\(m_{HCl}=0,6.36,5=21,9\left(g\right)\)
\(m_{ddHCl}=\dfrac{21,9.100}{20}=109,5\left(g\right)\)
Chúc bạn học tốt

nZn=6,5/65=0,1mol
a, Ta có pt:Zn+2HCl--->ZnCl2+H2
b, 0,1--->0,2mol
=>thể tích HCl cần dùng là:VHCl=n/Cm=0,2/2=0,1l
Ta có pt:NaOH+HCl--->NaCl+H2
0,2<----0,2mol
mNaOH cần dùng:mNaOH=0,2.40=8g
a) Zn + 2HCl => ZnCl2 + H2
b) n(Zn)= 6.5/65= 0.1 mol
n(hCl)= 36.5/36.5= 1 mol
So sánh tỉ lệ 0.1/1 < 1/2 => HCl dư
=> n(HCl)pu= 2n(Zn)= 0.2 mol=> n(HCl) dư= 0.8 mol
=> M(HCl) dư = 0.8*36.5=29.2g
c) Theo pt n(ZnCl2)= n(Zn)= 0.1 mol
=> M(ZnCl2)= 0.1*107= 10.7g
thank nha