Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn B.
Hai chất tan là Na2SO4 (0,05 mol) và Al2(SO4)3 (0,05 mol)
Þ Dung dịch X chứa CuSO4: 0,2 mol và NaCl: 0,1 mol
Tại catot có Cu (0,2 mol) và H2 (a mol) và tại anot có Cl2 (0,05 mol) và O2 (b mol)
→ BT : e 2 a + 0 , 2 . 2 = 0 , 05 . 2 + 4 b và mdd giảm = 0,2.64 + 2a + 0,05.71 + 32b = 20,55
Þ a = 0,1 và b = 0,125. Vậy t = 6h.

Giải thích: Đáp án A
Do dung dịch sau điện phân chứa 2 chất là: Na2SO4 và NaOH. Tỉ lệ mol CuSO4 và NaCl là 1:3 nên Cu2+ bị điện phân hết trước.
Al + OH-→AlO2-+ 1,5H2
=>nOH-=nH2/1,5=0,05 mol.
Quá trình điện phân:
Cu2+ + 2Cl- →Cu + Cl2
a 2a a a
2Cl- + 2H2O → Cl2 + H2 + 2OH-
a(=3a-2a) 0,5a 0,5a a=0,05
m giảm= 64a + 71a + 71.0,5a + 2.0,5a = 8,575 gam < 10,375
=> H2O bị điện phân: mH2O= 10,375-8,575 = 1,8 gam
H2O→H2+0,5O2
0,1 0,1 0,05 mol
Tại anot: 0,075 mol Cl2, 0,05 mol O2
=> ne= 0,075.2 + 0,05.4 = 0,35 mol=> t = ne.96500/I=0,35.96500/1,34=25205,2 giây = 7 giờ.
Chú ý: H2O bị điện phân

Chọn B.
Dung dịch Y chứa NaOH và Na2SO4.
Đặt số mol của CuSO4 và NaCl lần lượt là x và 3x mol.
Khi cho Al tác dụng với dung dịch Y thì:


Chọn A.
Tại thời điểm t (s) tại anot thu được khí Cl2 (0,05 mol) Þ ne (1) = 0,1 mol
Tại thời điểm 3,5t (s) tại anot có:
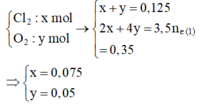
![]() và dung dịch Y chứa Cu2+ dư (a mol), H+ (0,2 mol), NO3-, K+
và dung dịch Y chứa Cu2+ dư (a mol), H+ (0,2 mol), NO3-, K+
Khi cho Y tác dụng với Fe thì: nFe pư =
= 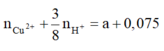
Chất rắn thu được gồm Fe dư và Cu Þ 20 – 56.(a + 0,075) + 64a = 16,4 Þ a = 0,075
Vậy dung dịch X gồm Cu(NO3)2 (0,25 mol) và KCl (0,15 mol) Þ m = 58,175 (g).
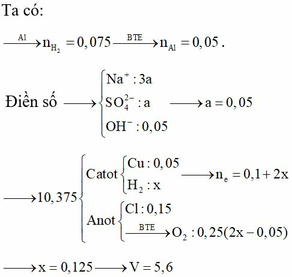






Chọn C.
Dung dịch Y chứa H+ với n H + = 2 n H 2 = 0 , 12 mol ⇒ H + ban đầu: 0 , 12 + 2 n H 2 ⇒ n O 2 = 0 , 03 + 0 , 5 n H 2
Khối lượng dung dịch giảm:
m Cu + m khí = 300 - 283 , 32 = 16 , 68 ⇒ 64 n Cu + 71 n Cl 2 + 18 n H 2 = 15 , 72 (1)
→ BT : e 2 n Cu = 0 , 12 + 2 n Cl 2 (2) và
160 n Cu + 117 n Cl 2 = 31 , 76 (3)
Từ (1), (2), (3) suy ra:
n Cu = 0 , 14 mol ; n Cl 2 = 0 , 08 mol ; n H 2 = 0 , 06 mol ⇒ n O 2 = 0 , 06 mol
Vậy V = 3,136 lít.