Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B.
Gọi số mol của Zn và Fe lần lượt là x và y mol
PTHH:
Zn + CuSO4 à ZnSO4 + Cu
x à x
Fe + CuSO4 à FeSO4 + Cu
y à y
Theo bài ta có: mrắn bđ = mrắn sau ó 65x + 56y = 64x + 64y ó x = 8y.
Coi số mol của Fe là 1 mol thì số mol của Zn là 8 mol.
Thành phần phần trăm theo khối lượng của Zn trong hỗn hợp bột ban đầu là:
![]()

Gọi a, b lần lượt là số mol của NaI và NaBr ban đầu, ta có : Sơ đồ phản ứng:
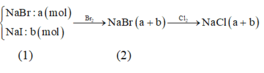

Đáp án A

Đáp án C
2107 gam dung dịch H2SO4 loãng, nồng độ 10% gồ 2,15 mol chất tan H2SO4 và 189,3 gam H2O.
→ kết quả cô cạn dung dịch Y thu được 1922,4 gam H2O là gồm lượng sẵn có trên là lượng sinh ra thêm do phản ứng giữa X + H 2 SO 4 ⇒ lượng sinh thêm là 26,1 gam ⇄ 1,45mol
*Sơ đồ phản ứng:
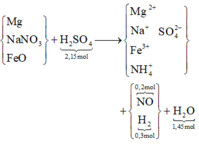
Có sơ đồ, việc giải bài tập trở nên đơn giản, chỉ là thuần “ban bật” bảo toàn nguyên tố qua dấu “ → ”:
Thật vậy, bảo toàn nguyên tố H có 0,2 mol NH 4 + → có 0,4 mol NaNO3 theo bảo toàn nguyên tố N.
Bỏ góc SO4 hai vế rồi bảo toàn nguyên tố O có 0,45 mol
![]()
Mà oxi chiếm 26,4% khối lượng X nên
![]()
Biết lượng FeO, NaNO3 rồi nên suy ra lượng còn lại 33,6 gam là của Mg.

Đáp án A
Ta có dãy điện hóa: ![]()
=>Zn phản ứng với C u 2 + trước
![]() khối lượng rắn giảm
khối lượng rắn giảm
![]() khối lượng rắn tăng
khối lượng rắn tăng
Do cuối cùng m rắn = m(g) =m hỗn hợp ban đầu =>tăng và giảm phải cân bằng với nhau.
Đặt nZn = x; nFe = y => m giảm = (65 - 64)x = x(g); m tăng = (64 - 65)y = 8y
m tăng = m giảm =>x = 8y =>%mZn = 65x/(65x - 56y)x100% = 90,27%

Đáp án A
Ta có dãy điện hóa: ![]()
=>Zn phản ứng với C u 2 + trước
![]()
=> Khối lượng rắn giảm
![]() => Khối lượng rắn tăng
=> Khối lượng rắn tăng
Do cuối cùng m rắn = m(g) =m hỗn hợp ban đầu =>tăng và giảm phải cân bằng với nhau.
Đặt n Z n = x ; n F e = y => m giảm = (65 - 64)x = x(g); m tăng = (64 - 56)y = 8y
m tăng = m giảm => x = 8y => %mZn = 65x : (65x - 56y).100% = 90,27%

Đáp án A
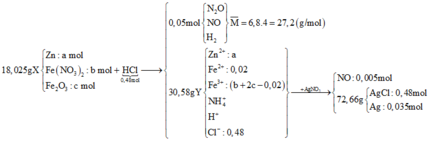
BTKL: mX + mHCl = mKhí + mY + mH2O
=> mH2O = 18,025 + 0,48.36,5 – 27,2.0,05 – 30,585= 3,6 (g) => nH2O = 0,2 (mol)
nH+dư ( trong Y) = 4nNO = 4. 0,005 = 0,02 (mol)
BTNT Cl => nAgCl = 0,48 (mol) => nAg = ( 72,66 – 0,48.143,5)/108 = 0,035 (mol)
Gọi a, b, c lần lượt là số mol của Zn, Fe(NO3)2 và Fe2O3 trong X
=> mX = 65a + 180b + 160c = 18,025 (1)
BTNT O: 6nFe(NO3)2 + 3nFe2O3 = nN2O + nNO + 2nH2O
=> nN2O + nNO = 6b + 3c -0,2
=> nH2 = ∑ nKhí - nN2O + nNO = 0,25 – 6b – 3c
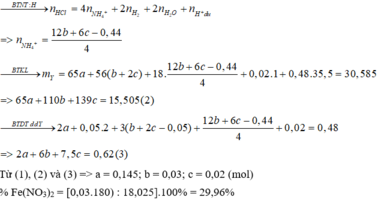

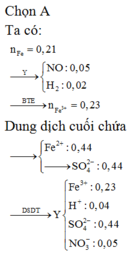
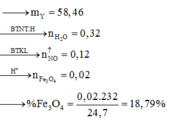
Gọi x, y lần lượt là số mol của Fe, FeO
nFeSO4.7H2O=111,2/278=0,4(mol)
Fe+H2SO4\(\rightarrow\)FeSO4+H2
x.......................x
FeO+H2SO4\(\rightarrow\)FeSO4+H2O
y.............................y
Ta có: nFeSO4=nFeSO4.7H2O=0,4(mol)
\(\Rightarrow\left\{{}\begin{matrix}x+y=0,4\\56x+72y=27,2\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,1\\y=0,3\end{matrix}\right.\)
%mFe=\(\dfrac{0,1.56}{27,2}.100=20,59\%\)
%mFeO=79,41%
Chúc bạn học tốt!
Định lượng FeO trong mẫu FeSO4 kỹ thuật. Khi hòa tan 0,9200g mẫu và tạo tủa dưới dạng Fe(OH)2. Nung tủa trong không khí được dạng cân Fe2O3 có khối lượng 0,2545g