Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nZn=0,4mol
nH2SO4=0,5mol
PTHH: Zn+H2SO4=>ZnSO4+H2
0,4:0,5=> nH2SO4 dư theo nZn
p/ư: 0,4->0,4----->0m4---->0,4
=> VH2=0,4.22,4=8,96ml
b) mZnSO4 tạo thành : m=0,4.161=64,4g
c) ta có mđ H2SO4=1,12.500=560g
mddZnSO4=26+560-0,4.2=585,2g
=> C%(ZnSO4)=64,4:585,2.100=11%

\(a.n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\\ PTHH:Fe+2HCl\rightarrow FeCl_2+H_2\\ b.n_{FeCl_2}=n_{H_2}=n_{Fe}=0,1\left(mol\right)\\ m_{FeCl_2}=127.0,1=12,7\left(g\right)\\ c.V_{H_2\left(đktc\right)}=0,1.22,4=2,24\left(l\right)\)

2Al+3H2SO4->al2(SO4)3+3H2
Fe+H2SO4->FeSO4+H2
Gọi x,y tương ứng là số mol của Al và Fe:
Ta có: 27x+56y=11 (1)
nH2=0,4 mol
1,5x+y=0,4 (2)
Giải hệ(1),(2):x=0,2;y=0,1
mAl=0,2.27=5,4g
%Al=\(\dfrac{5,4.100}{16,6}\)=32,53%
=>%Fe=67,47%
m H2SO4=0,4.98=39,2g
c) m muối=0,1.342+0,1.152=49,4g

b) Tính khối lượng H2SO4 dư sau pư, biết H2SO4 đã lấy dư so với lượng pư là 10%

a.
n Fe=28562856=0,5 (mol)
Fe+H2SO4→FeSO4+H2↑
0,5→0,5 0,5 0,5 (mol)
b.
V H2(đktc)=0,5.22,4=11,2 (l)
c.
m HCl=0,5.36,5=18,25 (g)
d.
m FeSO4=0,5.152=76 (g)

Bài 1) PTHH: CuO + H2SO4 → CuSO4 + H2O
Số mol của CuO là: 4 : 80 = 0,05 (mol)
Số mol của H2SO4 là: 0,05 . 1 = 0,05 (mol)
Khối lượng chất tan H2SO4 là: 0,05 . 98 = 4,9 gam
a) Khối lượng dung dịch H2SO4 là:
4,9 : 4,9% = 100 (gam)
Khối lượng CuSO4 tạo thành là: 0,05 . 160 = 8gam
Sau đó áp dụng định luật bảo toàn khối lượng để tính khối lượng dung dịch CuSO4 bằng cách tính tổng khối lượng các chất phản ứng ( Không trừ đi khối lượng nước ) từ đó ta được : Khối lượng của dung dịch CuSO4 là: 4 + 100 = 104 gam
C% dung dịch CuSO4 tạo thành là:
( 8 : 104 ) . 100% = 7,7%
Bài 2) PTHH: Fe + H2SO4 → FeSO4 + H2 ↑
Số mol của Fe là: 0,56 : 56 = 0,01(mol)
Số mol của H2 là: 0,01 . 1 = 0,01 (mol)
Thể tích hiđrô sinh ra là: 0,01 . 22,4 = 0,224 lít
b) Số mol của H2SO4 là: 0,01 . 1 = 0,01 mol
Khối lượng của H2SO4 là; 0,01 . 98 = 0,98 gam
Khối lượng dung dịch H2SO4 là:
0,98 : 19,6% = 5 (gam)
áp dụng định luật bảo toàn khối lượng :
Khối lượng dung dịch muối là:
5 + 0,56 - 0,02 = 5,54 (gam)
Khối lượng chất tan FeSO4 là: 0,01 . 152 = 1,52g
C% của dung dịch muối tạo thành là:
( 1,52 : 5,54 ) . 100% = 27,44%

a, \(n_{Fe}=\dfrac{0,56}{56}=0,01\left(mol\right)\)
PT: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
Theo PT: \(n_{FeSO_4}=n_{H_2}=n_{Fe}=0,01\left(mol\right)\)
\(\Rightarrow m_{FeSO_4}=0,01.152=1,52\left(g\right)\)
\(V_{H_2}=0,01.22,4=0,224\left(l\right)\)
b, \(n_{H_2SO_4}=n_{Fe}=0,01\left(mol\right)\Rightarrow m_{ddH_2SO_4}=\dfrac{0,01.98}{19,6\%}=5\left(g\right)\)
c, Ta có: m dd sau pư = 0,56 + 5 - 0,01.2 = 5,54 (g)
\(\Rightarrow C\%_{FeSO_4}=\dfrac{1,52}{5,54}.100\%\approx27,44\%\)

Mình thay trên câu a luôn nhé.
5. Số mol của Fe là :
nFe = 5,6/56 = 0,1 (mol)
a) Ta có PTHH :
Fe + 2HCl \(\rightarrow\) FeCl2 + H2\(\uparrow\)
1 mol 2 mol 1 mol 1 mol
0,1 mol 0,2 mol 0,1 mol 0,1 mol
Số mol của Fe là :
nFe = 5,6/56 = 0,1 (mol)
b) Khối lượng của FeCl2 tạo thành sau p.ứng là :
mFeCl2 = 0,1.127 = 12,7 (g)
c) Thể tích khí Hiđro (đktc) tạo thành sau p.ứng là :
VH2 = 0,1.22,4 = 2,24 (l)
4. Công thức của B là : NaxCyOz
+ \(m_{Na}=\frac{106.43,6}{100}\approx46\left(g\right)\)
\(m_C=\frac{106.11,3}{100}\approx12\left(g\right)\)
\(m_O=\frac{106.45,3}{100}\approx48\left(g\right)\)
+ \(n_{Na}=\frac{46}{23}=2\left(mol\right)\)
\(n_C=\frac{12}{12}=1\left(mol\right)\)
\(n_O=\frac{48}{16}=3\left(mol\right)\)
Suy ra trong một p.tử h/c có 2 n.tử Na, 1 n.tử C và 3 n.tử O.
\(\Rightarrow\) CTHH của hợp chất B là Na2CO3.
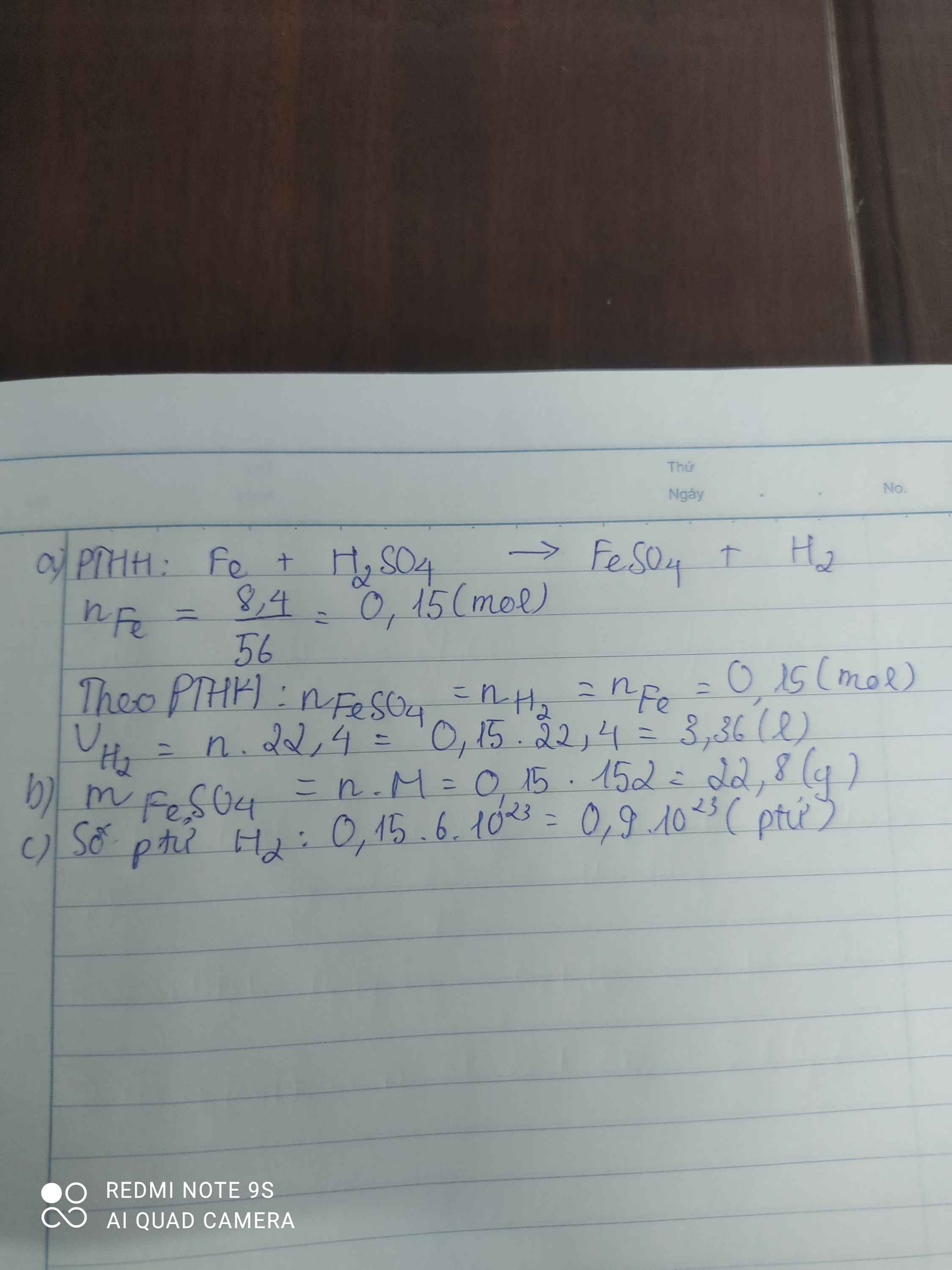
\(n_{Fe_3O_4}=\dfrac{23.2}{232}=0.1\left(mol\right)\)
\(PTHH:Fe_3O_4+4H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+FeSO_4+4H_2O\)
\(...........0.1....................0.1.......0.1.........0.1\)
\(m_{FeSO_4}=0.1\cdot152=15.2\left(g\right)\)
\(m_{Fe_2\left(SO_4\right)_3}=0.1\cdot400=40\left(g\right)\)
\(m_{H_2O}=0.1\cdot18=1.8\left(g\right)\)
a)
$Fe_3O_4 + 4H_2SO_4 \to FeSO_4 + Fe_2(SO_4)_3 + 4H_2O$
b)
Theo PTHH :
$n_{FeSO_4} = n_{Fe_2(SO_4)_3} = n_{Fe_3O_4} = \dfrac{23,2}{232} = 0,1(mol)$
$m_{FeSO_4} = 0,1.152 = 15,2(gam)$
c)
$m_{Fe_2(SO_4)_3} = 0,1.400 = 40(gam)$
d)
$n_{H_2O} = 4n_{Fe_3O_4} = 0,4(mol)$
$m_{H_2O} = 0,4.18 = 7,2(gam)$