Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{FeO}=\dfrac{0,36}{72}=0,005\left(mol\right)\)
\(n_{H_2SO_4}=2n_{FeO}=0,01\left(mol\right)\\ \Rightarrow m_{ddH_2SO_4}=\dfrac{0,01.98}{98\%}=1\left(g\right)\\ n_{Fe_2\left(SO_4\right)_3}=\dfrac{1}{2}n_{FeO}=0,0025\left(mol\right)\\ \Rightarrow m_{Fe_2\left(SO_4\right)_3}=0,0025.400=1\left(g\right)\)

Đáp án C
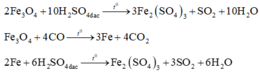
Coi oxit sắt ban đầu là hỗn hợp gồm Fe và O với nFe = a và nO = b.

Với lần thí nghiệm thứ nhất, có sự tham gia của O. Áp dụng định luật bảo toàn mol electron, ta có:
![]()
Với lần thí nghiệm thứ hai, không có sự tham gia của O. Áp dụng định luật bảo toàn mol
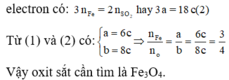

Đáp án C
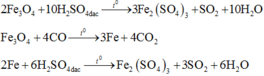
Coi oxit sắt ban đầu là hỗn hợp gồm Fe và O với nFe = a và nO = b.
Gọi thì ![]()
Các quá trình nhường và nhận electron diễn ra như sau:
Quá trình nhường electron:



\(n_{Fe} = \dfrac{11,2}{56} = 0,2(mol)\\ \Rightarrow n_{Fe_2(SO_4)_3} = \dfrac{1}{2}n_{Fe} = 0,1(mol)\\ \Rightarrow m_{Fe_2(SO_4)_3} = 0,1.400 = 40(gam) \)
\(m_{O_2}=14.4-11.2=3.2\left(g\right)\)
\(n_{O_2}=\dfrac{3.2}{32}=0.1\left(mol\right)\)
\(O_2+4e\rightarrow2O^{2-}\)
\(0.1....0.4\)
\(S^{+6}+2e\rightarrow S^{+4}\)
\(.......0.4.....0.2\)
\(n_{H_2SO_4}=2\cdot0.2=0.4\left(mol\right)\)
\(n_{H_2O}=\dfrac{1}{2}n_{H_2SO_4}=\dfrac{0.4}{2}=0.2\left(mol\right)\)
\(BTKL:\)
\(m_{Muối}=14.4+0.4\cdot98-0.2\cdot64-0.2\cdot18=37.2\left(g\right)\)

a,\(3Fe+2O_2\rightarrow Fe_3O_4\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(Fe_3O_4+8HCl\rightarrow2FeCl_3+FeCl_2+4H_2O\)
\(n_{H2}=\frac{0,448}{22,4}=0,02\left(mol\right)\)
\(\Rightarrow n_{Fe}=n_{H2}=0,02\left(mol\right)\)
\(\Rightarrow\%_{Fe}=\frac{6,72-0,02.56}{6,72}.100\%=83,33\%\)
b,\(n_{Fe3O4}=\frac{1}{30}\left(mol\right)\)
\(m_{FeCl3}=\frac{1}{15}.162,5=10,83\left(g\right)\)
\(\Rightarrow m_{FeCl2}=\left(\frac{1}{30}+0,02\right).127=6,773\left(g\right)\)



gọi hóa trị của Fe của oxit sắt là:x
\(Fe_2O_x+xH_2SO_4\rightarrow Fe_2\left(SO_4\right)_x+xH_2O\)
dựa vào phương trình ta thấy \(n_{Fe_2O_x}=n_{Fe_2\left(SO_4\right)_x}\):
\(\Leftrightarrow\dfrac{16}{56.2+16x}=\dfrac{40}{56.2+\left(32+64\right)x}\)
\(\Leftrightarrow x=3\)
vậy oxit sắt đó là:sắt (III) oxit (\(Fe_2O_3\)
Bạn ơi, cho mình hỏi nếu oxit sắt tác dụng với H2SO4 đặc nóng, làm sao mình biết sản phẩm nó là H2O được vậy?