Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi \(\left\{{}\begin{matrix}n_{Cu}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\end{matrix}\right.\left(đk:a,b>0\right)\)
PTHH:
\(Cu+2H_2SO_{4\left(đặc,nóng\right)}\rightarrow CuSO_4+SO_2\uparrow+2H_2O\)
a------------------------------->a
\(2Fe+6H_2SO_{4\left(đặc,nóng\right)}\rightarrow Fe_2\left(SO_4\right)_3+3SO_2\uparrow+6H_2O\)
b----------------------------------->0,5b
\(2NaOH+CuSO_4\rightarrow Cu\left(OH\right)_2\downarrow+Na_2SO_4\)
a---------->a
\(6NaOH+Fe_2\left(SO_4\right)_3\rightarrow2Fe\left(OH\right)_3\downarrow+3Na_2SO_4\)
0,5b----------->a
Theo bài ra, ta có hệ: \(\left\{{}\begin{matrix}160a+400.0,5b=71,2\\98a+107b=40,2\end{matrix}\right.\)
\(\Leftrightarrow\left\{{}\begin{matrix}a=0,17\left(mol\right)\\b=0,22\left(mol\right)\end{matrix}\right.\left(TM\right)\)
\(\rightarrow m=0,17.64+0,22.56=23,2\left(g\right)\)

Quy đổi hỗn hợp kim loại thành R, có soh là +n
\(n_R=\dfrac{17,1}{M_R}\left(mol\right)\)
R0 - ne --> R+n
\(\dfrac{17,1}{M_R}\)->\(\dfrac{17,1n}{M_R}\)
S+6 + 2e --> S+4
1<---0,5
Bảo toàn e: \(\dfrac{17,1n}{M_R}=1\Rightarrow M_R=17,1n\)
Muối thu được có CTHH là R2(SO4)n
\(n_{R_2\left(SO_4\right)_n}=\dfrac{17,1}{2.M_R}\left(mol\right)\)
=> \(m_{R_2\left(SO_4\right)_n}=\dfrac{17,1}{2.M_R}\left(2.M_R+96n\right)=17,1+\dfrac{820,8n}{M_R}=65,1\left(g\right)\)

Đáp án C
Quy đổi hỗn hợp về Fe (x mol); Cu (y mol) và S (z mol)
Bảo toàn S có
nS = n↓ = 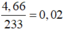 (mol)
(mol)
mX = 2,72 gam → 56x + 64y + 0,02.32 = 2,72 → 56x + 64y = 2,08 (1)
Do Y có thể hòa tan được Cu, bảo toàn electron có:
3.nFe + 2.nCu + 6.nS = 3.0,07 → 3x + 2y = 0,09 (2)
Từ (1) và (2) có: x = 0,02 và y = 0,015.
Dung dịch Y gồm: Fe3+: 0,02 mol; Cu2+: 0,015 mol; SO42- = 0,02 mol; NO3- = (0,5 – 0,07 = 0,43 mol) và có thể có H+
Bảo toàn điện tích → nH+ = 0,38 mol
Cho Cu vào Y có phản ứng:
3Cu + 8H+ + 2NO3- → 3Cu2+ + 2NO + 4H2O
0,1425 ← 0,38 0,43 mol
Cu + 2Fe3+ → Cu2+ + 2Fe2+
0,01 ← 0,02 mol
m = (0,01 + 0,1425).64 = 9,76 gam.

Này nhé: Quy hh X về hh chỉ gồm: Cu,S. Sau đó bạn đắt mol rồi giải
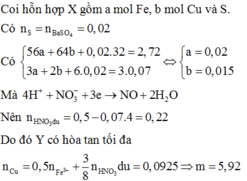


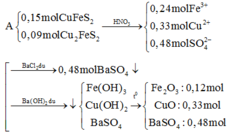
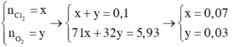
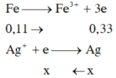
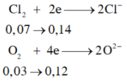
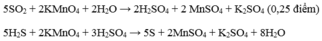

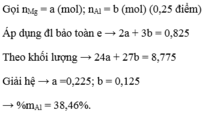
\(X\left\{{}\begin{matrix}Cu:a\left(mol\right)\\S:b\left(mol\right)\end{matrix}\right.\underrightarrow{^{H2SO4}}\left\{{}\begin{matrix}CuSO4\\SO_2\end{matrix}\right.\)
\(n_{SO2}=0,54\left(mol\right)\)
Giải hệ PT:
\(\left\{{}\begin{matrix}64a+32b=15,36\\2a+6b=0,54.2=1,08\left(BT.e\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}a=0,18\\b=0,12\end{matrix}\right.\)
\(n_{CuSO2}=n_{Cu}=0,18\left(mol\right)\)
\(CuSO_4+Ba\left(OH\right)_2\rightarrow BaSO_4+Cu\left(OH\right)_2\)
0,18_______________0,18_______0,18_______
\(\Rightarrow m_{\downarrow}=m_{Cu\left(OH\right)_2}+m_{BaSO_4}=59,58\left(g\right)\)