Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

MgCO3 + 2HCl → MgCl2 + CO2 + H2O (1)
BaCO3 + 2HCl → BaCl2 + CO2 + H2O (2)
CO2 + Ca(OH)2 → CaCO3↓ + H2O. (3)
Theo (1), (2) và (3), để lượng kết tủa B thu được là lớn nhất thì:
nCO2 = nMgCO3 + nBaCO3 = 0,2 mol
Ta có: 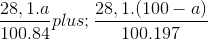 = 0,2
= 0,2
=> a = 29,89.

bạn có ghi bài trên lớp phần cấu tạo chất đủ không. co mình mượn chép lại mấy bài phần đó với

C2H2 + 2AgNO3 + 2NH3 → C2Ag2 ↓ + 2NH4NO3
CH3CHO + 2AgNO3 + 3NH3 + H2O → CH3COONH4 + 2Ag ↓ + 2NH4NO3
C2Ag2 + 2HCl → 2AgCl ↓ + C2H2 ↑
Y(AgCl, Ag) + HNO3 --> ...
Ag + 2HNO3 → AgNO3 + NO2 ↑ + H2O

VO2(pư)=1/5Vkk=8.4(l).theo bài ra ta có nCO2+N2=44.8/22.4=2(1)lại có dB/H2=15=>nCO2/nN2=1/7(2).từ (1)và(2)=>nCO2=0.25(mol)và nN2=1.75(mol).
áp dụng ĐLBTKL ta có m=mCO2+mH2O+mN2-mO2(pư)=57(gam).ta lại có mC+mH+mN=nCO2.12+2.nH2O+28.nN2=53(gam) <57(gam)=>trong A có nguyên tố oxi mO=57-53=4(gam).gọi CTĐGN của A là CxHyOzNt ta có:x:y:z:t=nCO2:2nH2O:nO:2nN2=1:4:1:14=>CTĐGN của A:CH4ON14.lại có 12n+4n+16n+196n=600(tớ nghĩ phải là 600 chứ A chứa nhiều nguyên tố lắm)=>n=3=>CTHH của A:C3H12O3N42.

a) Khối lượng TNT thu được.
b) Khối lượng axit HNO3 đã phản ứng.
Hướng dẫn.
- HS viết pthh ở dạng CTPT.
- Tìm mối liên quan giữa chất đã biết và chất rắn cần tìm.
ĐS: Khối lượng TNT là: = 56,75 (kg).
Khối lượng HNO3 Phản ứng là: = 47,25 (kg).

-\(n_{Fe}=\frac{11,2}{56}=0,2mol\) \(n_{Al}=\frac{m}{27}mol\) |
-khi thêm \(Fe\) vào cốc đựng \(HCl\) ( cốc A ) có phản ứng: \(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\) 0,2 0,2 |
theo định luật bảo toàn khối lượng, khối lượng cốc \(HCl\) tăng thêm: \(11,2-\left(0,2.2\right)=10,8g\) |
khi thêm \(Al\) vào cốc đựng dd \(H_2SO_4\) có phản ứng: \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\uparrow\) \(\frac{m}{27}mol\) \(\rightarrow\) \(\frac{3.m}{27.2}mol\) |
| khi cho \(m\) gam \(Al\) vào cốc B, cốc B tăng thêm : \(m-\frac{3.m}{27.2}mol\) |
để cân thăng bằng, khối lượng ở cốc đựng \(H_2SO_4\) cũng phải tăng thêm 10,8g.Có: \(m-\frac{3.m}{27.2}.2=10,8\)
|
| giải ra được \(m=\) \(\left(g\right)\) |

Bài giải:
- Vì =
=>
=
, suy ra polime đó là polietilen (-CH2 – CH2 - )n.
- Không thể là tinh bột (-C6H10O5-)n, vì có tỉ lệ =
, cũng không thể là PVC vì chất này khi cháy phải có sinh ra hợp chất chứa clo.


Đáp án : C
Bảo toàn e :
3nAl + 2nMg= 2 n S O 2 + 3 n N O + n N O 2 + 8 n N 2 O = 1,4 mol
Và 27nAl + 24nMg = 15g
=> nAl = 0,2 mol
=> %mAl = 36%