Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi CTHH của oxit sắt là FexOy.
PT: \(ZnO+H_2\underrightarrow{t^o}Zn+H_2O\)
\(Fe_xO_y+yH_2\underrightarrow{t^o}xFe+yH_2O\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
B gồm: Zn và Fe.
Gọi: \(\left\{{}\begin{matrix}n_{Zn}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\end{matrix}\right.\) ⇒ 65a + 56b = 17,7 (1)
Theo PT: \(n_{H_2}=n_{Zn}+n_{Fe}=a+b=\dfrac{6,72}{22,4}=0,3\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=0,1\left(mol\right)\\b=0,2\left(mol\right)\end{matrix}\right.\)
Theo PT: \(\left\{{}\begin{matrix}n_{ZnO}=n_{Zn}=0,1\left(mol\right)\\n_{Fe_xO_y}=\dfrac{1}{x}n_{Fe}=\dfrac{0,2}{x}\left(mol\right)\end{matrix}\right.\)
Có: mZnO + mFexOy = 24,1 ⇒ mFexOy = 24,1 - 0,1.81 = 16 (g)
\(\Rightarrow M_{Fe_xO_y}=\dfrac{16}{\dfrac{0,2}{x}}=80x\left(g/mol\right)\)
\(\Rightarrow56x+16y=80x\Rightarrow\dfrac{x}{y}=\dfrac{2}{3}\)
Vậy: CTHH cần tìm là Fe2O3.
\(\Rightarrow\left\{{}\begin{matrix}\%m_{ZnO}=\dfrac{0,1.81}{24,1}.100\%\approx33,61\%\\\%m_{Fe_2O_3}\approx66,39\%\end{matrix}\right.\)

\(PTHH:Fe+2HCl\rightarrow FeCl_2+H_2\)
Ta có:
\(n_{H2}=\frac{6,72}{22,4}=0,3\left(mol\right)\)
\(\Rightarrow n_{Fe}=n_{H2}=0,3\left(mol\right)\)
Hỗn hợp có 0,3.56= 16,8g Fe
\(m_{oxit}=40-16,8=23,2\left(g\right)\)
Coi oxit gồm Fe và O
\(m_{giam}=40-33,6=6,4\left(g\right)=m_O\)
\(\Rightarrow m_{Fe\left(oxit\right)}=23,2-6,4=16,8\left(g\right)\)
\(\left\{{}\begin{matrix}n_{Fe}=\frac{16,8}{56}=0,3\left(mol\right)\\n_O=\frac{6,4}{12}=0,4\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow n_{Fe}:n_O=0,3:0,4=3:4\)
Vậy oxit là Fe3O4
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Fe}=\frac{16,8}{40}.100\%=42\%\\\%m_{Fe3O4}=100\%-42\%=58\%\end{matrix}\right.\)

Bài 2:
nX=0,8(mol)
nO2=1,6(mol)
nH2=nC2H2=0,4(mol)
2C2H2 + 5O2 -> 4CO2 + 2H2O
0,4----->1---------->0,8
2H2 + O2 -> 2H2O
0,4---->0,2
nCO2=0,8(mol)
nO2 dư=1,6-1-0,2=0,4(mol)
%VCO2=0,8:1,2=66,67%
%VO2=33,33%
Bài 1:
nH2=0,04(mol)
nFe=nH2=0,04(mol)
mCu=3,52-0,04.56=1,28(g)<=>0,02(mol)
nCuO=nO trong Cu=nCu=0,02(mol)
%mCuO=\(\frac{0,02.80}{4,8}.100\%=33,3\%\)
=>%mFexOy=100-33,3=66,7%
nO trong oxit sắt=\(\frac{4,8-3,52}{16}-0,02=0,06\left(mol\right)\)
\(\frac{x}{y}=\frac{0,04}{0,06}=\frac{2}{3}\)
=>Fe2O3

Gọi \(\left\{{}\begin{matrix}n_{CuO}=a\left(mol\right)\\n_{Fe_xO_y}=a\left(mol\right)\end{matrix}\right.\)
=> 80a + 56ax + 16ay = 2,4 (1)
\(n_{H_2}=\dfrac{0,448}{22,4}=0,02\left(mol\right)\)
PTHH: CuO + H2 --to--> Cu + H2O
FexOy + yH2 --to--> xFe + yH2O
a---------------->ax
Fe + 2HCl --> FeCl2 + H2
ax--------------------->ax
=> \(ax=0,02\left(mol\right)\)
=> a = \(\dfrac{0,02}{x}\)
Thay vào (1)
\(80.\dfrac{0,02}{x}+56.0,02+\dfrac{16.0,02y}{x}=2,4\)
=> \(\dfrac{1,6}{x}+\dfrac{0,32y}{x}=1,28\)
=> 1,28x = 0,32y + 1,6
Chọn x = 2; y = 3 thỏa mãn
=> CTHH: Fe2O3

1 ) CAO +H2O => CA(OH)2 (1)
2K + 2H2O => 2KOH + H2(2)
n (H2) =1,12/22,4 =0,05
theo ptpư 2 : n(K) = 2n (h2) =2.0.05=0,1(mol)
=> m (K) =39.0,1=3,9 (g)
% K= 3,9/9,5 .100% =41,05%
%ca =100%-41,05%=58,95%
xo + 2hcl =>xcl2 +h2o
10,4/X+16 15,9/x+71
=> giải ra tìm đc X bằng bao nhiêu thì ra

câu b làm lại
\(n_{H2}=n_{Fe}=0,2\left(mol\right)\)
\(V_{H2}=0,2.22,4=4,48\left(l\right)\)
Theo bài có pthh:
Fe2O3 + 3H2 -> 2Fe + 3H2O (1)
FeO + H2 -> Fe + H2O (2)
Fe + 2HCl -> FeCl2 + H2 (3)
Theo bài ra ta có:
nFe(pt3) = 1\2 . nHCl = 1\2 . 0,4 = 0,2 mol
Gọi a, b lần lượt là số mol của Fe2O3 và FeO (a,b>0)
=> mFe2O3 = a. MFe2O3 = 160a (g)
mFeO = b. MFeO = 72b (g)
=> mhh = mFe2O3 + mFeO
⇔ 15,2 = 160a + 72b (I)
Theo pthh ta có:
nFe(pt1) = 2 . nFe2O3 = 2a (mol)
nFe(pt2) = nFeO = b (mol)
=> nFe(tgpư) = nFe(bđ) = nFe(pt1) + nFe(pt2)
⇔ 0,2 = 2a + b (II)
Từ (I)(II) ta có hệ phương trình:
+ 160a + 72b = 15,2
+ 2a + b = 0,2
=> a = 0,05(TM) ; b = 0,1 (TM)
=> nFe2O3 = a = 0,05 mol
nFeO = b = 0,1 mol
=> %mFe2O3 = mFe2O3.100%\mhh
= 8.100%15,28.100%\15,2 ≈ 52,63 %
=> %mFeO = 100% - 52,63% = 47,37%
Ta có: nHCl = 0,4 mol ; nFe = 0,2 mol
=> nH2 = 1/2 . nHCl = nFe = 0,2 mol
=> VH2 = nH2 . 22,4 = 0,2 . 22,4 = 4,48 (l)
Vậy...

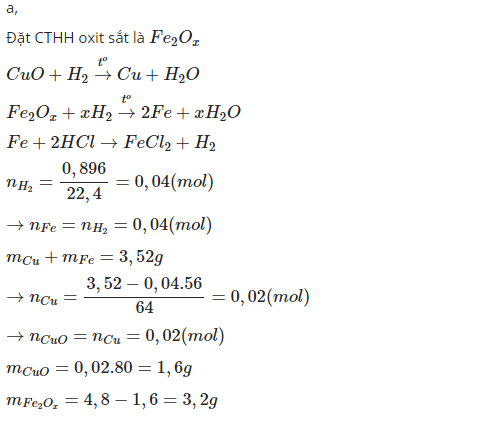
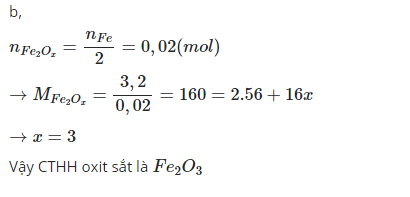
\(PTHH:\)
\(Fe+H_2SO_4--->FeSO_4+H_2\)\((1)\)
\(2Fe_xO_y+2yH_2SO_4--->xFe_2\left(SO_4\right)_{\dfrac{2y}{x}}+2yH_2O\) \((2)\)
\(nH_2(đktc)=\dfrac{1,12}{22,4}=0,05(mol)\)
Theo PTHH (1) \(nFe=0,05(mol)\)
\(=>mFe=0,1.56=5,6(g)\)
\(=>mFe_xO_y=10,8-5,6=5,2(g)\)\((I)\)
\(=>\%mFe=51,85\%\)
\(=>\%mFe_xO_y=48,15\%\)
Khi cho khí Hidro qua 5,4 gam hỗn hợp A đun nóng thì :
\(Fe_xO_y+yH_2-t^o->xFe+yH_2O\)\((3)\)
Chất rắn sau phản ứng là Fe
\(nFe=\dfrac{4,2}{56}=0,075(mol)\)
Theo PTHH (3) \(nFe_xO_y=\dfrac{0,075}{x}(mol)\)
=> Trong 10,8 gam hỗn hợp A có:
\(nFe_xO_y= \dfrac{0,075}{x}.\dfrac{10,8}{5,4}=\dfrac{0,15}{x}(mol)\)\((II)\)
Từ (I) và (II) , ta có: \(5,2=\dfrac{0,15}{x}.\left(56x+16y\right)\)
\(< =>3,2x=2,4y\)
\(=>\dfrac{x}{y}=\dfrac{2,4}{3,2}=\dfrac{3}{4}\)
\(=>CT: \) \(Fe_3O_4\)
Theo đề ta có PTHH:
Fe + H2SO4\(\underrightarrow{t^o}\) FeSO4 + H2 (1)
2FexOy + 2yH2SO4 \(\underrightarrow{t^o}\) \(xFe\left(SO_4\right)_{\dfrac{2y}{x}}\) + 2yH2O (2)
FexOy + yH2 \(\underrightarrow{t^o}\) xFe + yH2O (3)
a. Khí thu được sau khi hòa tan hỗn hợp A vào dd H2SO4 là H2
Theo đề: \(n_{H_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
Theo PTHH (1):
nFe=\(n_{H_2}\)=0,05(mol)
=> mFe = 0,05.56 = 2,8 (g)
=>%mFe= \(\dfrac{2,8}{10,8}.100\%=25,93\%\)
=> %\(m_{Fe_xO_y}\)= 100 - 25,93= 74,07%
b. Khi khử hoàn toàn hỗn hợp A bằng H2 , chỉ có FexOy tác dụng với H2 => chất rắn thu được sau phản ứng gồm: Fe có trong hỗn hợp, Fe sau pư
mFe(hh)= 5,4.25,93%=1,4 (g)
=> mFe(3)= 4,2-1,4=2,8 (gg)
=> nFe(3)= \(\dfrac{2,8}{56}=0,05\left(mol\right)\)
Theo PTHH(3): \(n_{Fe_xO_y}=\dfrac{1}{x}n_{Fe}=\dfrac{0,05}{x}\left(mol\right)\)
\(m_{Fe_xO_y}\)=5,4-1,4=4 (g)
=> \(n_{Fe_xO_y}=\dfrac{4}{56x+16y}\left(mol\right)\)
Ta có: \(\dfrac{0,05}{x}=\dfrac{4}{56x+16y}\Rightarrow2,8x+0,8y=4x\)
<=> 1,2x=0,8y => \(\dfrac{x}{y}=\dfrac{0,8}{1,2}=\dfrac{2}{3}\)
=> x=2;y=3
=> CTHH: Fe2O3