Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
Nhìn vào đề bài nhận thấy tất cả các số liệu đề cho cũng như đáp án đều ở dạng số liệu tương đối. Do đó nhận thấy dấu hiệu của phương pháp tự chọn lượng chất. Ta có thể chọn cho số mol metan có ban đầu là 1 mol

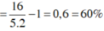

Đáp án B
Giả sử ban đầu có 1 mol CH4. Gọi số mol CH4 phản ứng là x mol.
2CH4 à C2H2 + 3H2
x 0,5x 1,5x
Ta có: 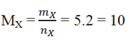
Áp dụng định luật bảo toàn khối lượng ta có: 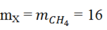
Hỗn hợp X gồm CH4 dư: (1-x) mol; C2H2: 0,5 mol và H2 : 1,5x mol.
Ta có: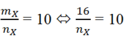
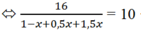
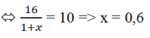

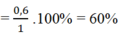

Đáp án D
MX = 0,4.58 = 23,2 nên mX = 0,6.23,2 = 13,92 g
Do đó 0,6 mol X được tạo từ 13,92 : 58 = 0,24 mol C4H10
nX – nC4H10 = nH2 = 0,6 - 0,24 = 0,36 mol
X + Br2 thì nBr2 = nH2 = 0,36 mol

Đáp án D
MX = 0,4.58 = 23,2 nên mX = 0,6.23,2 = 13,92 g
Do đó 0,6 mol X được tạo từ 13,92 : 58 = 0,24 mol C4H10
nX – nC4H10 = nH2 = 0,6 - 0,24 = 0,36 mol
X + Br2 thì nBr2 = nH2 = 0,36 mol

Gọi số mol CH4 ban đầu là 1 (mol), số mol phản ứng là a (mol)
PTHH: 2CH4--to, làm lạnh nhanh--> C2H2 + 3H2
Trc pư: 1 0 0
Pư: a--------------------------->0,5a--->1,5a
Sau pư: (1-a) 0,5a 1,5a
=> \(\Sigma n=\left(1-a\right)+0,5a+1,5a=1+a\left(mol\right)\)
\(m_X=m_{CH_4\left(bđ\right)}=1.16=16\left(g\right)\)
=> \(\overline{M}_X=\dfrac{16}{1+a}=5.2=10\)
=> a = 0,6 (mol)
=> \(H\%=\dfrac{0,6}{1}.100\%=60\%\)

Đáp án C
Đốt cháy hoàn toàn E thu được n H 2 O = n C O 2
=> este no, đơn chức, mạch hở
=> ancol và axit cũng no, đơn chức, mạch hở.
Xét ancol X ta có: n H 2 = 0 , 05 ( m o l )
⇒ n a n c o l = 2 n H 2 = 0 , 1 ( m o l ) ⇒ M a n c o l = 46 ⇒ a n c o l l à C 2 H 5 O H
Xét axit Y ta có: n H 2 = 0 , 075 ( m o l )
n a x i t = 2 n H 2 = 0 , 15 ( m o l ) ⇒ M Y = 60
=>axit là CH3COOH
=> este là CH3COOC2H5 => neste =0,075(mol)
Nếu H = 100% thì ancol hết => H tính theo ancol.
Vậy H = 0 , 075 0 , 1 = 75 %

Đáp án C
Nhận thấy đốt cháy X tương đương đốt cháy metan
→ nCH4 = nO2 : 2 = 0,15 mol
Luôn có mCH4 = mX→ nX =
0
,
15
.
16
4
,
8
.
2
= 0,25 mol
nX - nCH4 = nCH4 pư → nCH4 pứ = 0,1 mol
Vậy H =
0
,
1
0
,
15
×100% = 66,67%.
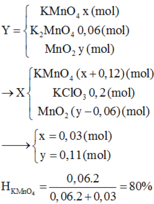
Hiệu ứng nhiệt khi cho 0,01 kg Na phản ứng với H2O là 79910J
(1 mol) 0,023 kg__________________183793J = 183,793 kJ
Hiệu ứng nhiệt khi cho 0,02 kg Na phản ứng với H2O là 76755J
(1 mol) 0,062 kg_________________237940,5J = 237,9405 kJ
\(\text{(1) Na + H2O → NaOH + 0,5 H2____________ ΔH1 = 183,793 kJ/mol}\)
\(\text{(2) Na2O + H2O → 2NaOH_____________ ΔH2 = 237,9405 kJ/mol}\)
\(\text{(3) H2 + 0,5 O2 → H2O ______________ ΔH3 = -285,84 kJ/mol}\)
\(\text{(4) 2Na + 0,5 O2 → Na2O_____________ ΔH4 = ?}\)
Ta thấy: (4) = 2.(1) - (2) + (3)
→ ΔH4 = 2.ΔH1 - ΔH2 + ΔH3
= 2.183,793 - 237,9405 + (-285,84)
= -156,1945 kJ/mol