Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(FeO:\%m_{Fe}=\left(56.100\right):\left(56+16\right)=77,78\%\)
\(Fe_2O_3:\%m_{Fe}=\left(56.2.100\right):\left(56.2+16.3\right)=70\%\)
\(Fe_3O_4:\%m_{Fe}=\left(56.3.100\right):\left(56.3+16.4\right)=72,71\%\)
\(FeCO_3:\%m_{Fe}=\left(56.100\right):\left(56+12+16.3\right)=48,28\%\)

\(\%m_{Fe\left(FeO\right)}=\frac{56}{56+16}\cdot100\%\approx77,78\%\)
\(\%m_{Fe\left(Fe_2O_3\right)}=\frac{56\cdot2}{56\cdot2+16\cdot3}\cdot100\%=70\%\)
\(\%m_{Fe\left(Fe_3O_4\right)}=\frac{56\cdot3}{56\cdot3+16\cdot4}\cdot100\%\approx72,41\%\)
\(\%m_{Fe\left(FeCO_3\right)}=\frac{56}{56+12+16\cdot3}\cdot100\%\approx48,28\%\)

| Feo | Fe2O3 | Fe3O4 |
%mFe= (56.100):(56+16)=77,78% | %mFe= (56.2.100):(56.2+16.3)=70% | %mFe=(56.3.100):(56.3+16.4)=72,71% |
=> tỉ lệ sắt trong FeO cao nhất

1) MM= \(\dfrac{m}{n}\)=\(\dfrac{11,5}{0,5}\)= 23(g/mol)
2) Gọi oxit sắt có 70% sắt là FexOy
=> \(\dfrac{56x}{56x+16y}.100=70\)
<=> 56x = 39,2x + 11,2y
<=> 16,8x = 11,2y
<=> x:y = 2:3
=> Công thức hóa học của oxit sắt là Fe2O3

$a\bigg)$
$FeO+H_2\xrightarrow{t^o}Fe+H_2O$
$Fe_2O_3+3H_2\xrightarrow{t^o}2Fe+3H_2O$
$Fe_3O_4+4H_2\xrightarrow{t^o}3Fe+4H_2O$
$PbO+H_2\xrightarrow{t^o}Pb+H_2O$
$ZnO+H_2\xrightarrow{t^o}Zn+H_2O$
$b\bigg)$
$FeO+CO\xrightarrow{t^o}Fe+CO_2$
$Fe_2O_3+3CO\xrightarrow{t^o}2Fe+3CO_2$
$Fe_3O_4+4CO\xrightarrow{t^o}3Fe+4CO_2$
$PbO+CO\xrightarrow{t^o}Pb+CO_2$
$ZnO+CO\xrightarrow{t^o}Zn+CO_2$
$c\bigg)$
$2FeO+C\xrightarrow{t^o}2Fe+CO_2$
$2Fe_2O_3+3C\xrightarrow{t^o}4Fe+3CO_2$
$Fe_3O_4+2C\xrightarrow{t^o}3Fe+2CO_2$
$2PbO+C\xrightarrow{t^o}2Pb+CO_2$
$2ZnO+C\xrightarrow{t^o}2Zn+CO_2$

\(M_{FeO}=56+16=72\left(g/mol\right)\)
\(\%m_{Fe}=\dfrac{56}{72}.100\%\approx77,7\%\)
\(M_{Fe_2O_3}=56\times2+16\times3=160\left(g/mol\right)\)
\(\%m_{Fe}=\dfrac{56\times2}{160}.100\%=70\%\)
\(M_{Fe_3O_4}=56\times3+16\times4=232\left(g/mol\right)\)
\(\%m_{Fe}=\dfrac{56\times3}{232}.100\%\approx72,4\%\)
So sánh hàm lượng sắt có trong oxit trên
→ Hàm lượng sắt trong oxit \(FeO\) cao nhất
Hàm lượng sắt có trong FeO là:
\(\%Fe=\dfrac{56}{56+16}\times100\%=77,78\%\)
Hàm lượng sắt có trong Fe2O3 là:
\(\%Fe=\dfrac{56\times2}{56\times2+16\times3}\times100\%=70\%\)
Hàm lượng sắt có trong Fe3O4 là:
\(\%Fe=\dfrac{56\times3}{56\times3+16\times4}\times100\%=72,41\%\)
Ta có: \(77,78\%>72,41\%>70\%\)
Vậy hàm lượng sắt trong FeO > hàm lượng sắt trong Fe3O4 > hàm lượng sắt trong Fe2O3

\(n_{Fe}=\frac{1}{56}\left(mol\right)\)
PT: \(xFe+\frac{y}{2}O_2-to->Fe_xO_y\)
theo PT ta có:
\(n_{Fe_xO_y}=\frac{1}{56}x\left(mol\right)\)
=> \(m_{Fe_xO_y}=\frac{1}{56}x.\left(56x+16y\right)>1,4\)
=> \(\frac{16y}{56x}>1,41\)
=> \(\frac{y}{x}>0,41:\frac{16}{56}=1,435\)
=> chọn \(x=2,y=3\) là thỏa mãn
=> oxit đó là: \(Fe_2O_3\)
Khi sắt tiếp xúc với oxi sẽ bị oxi hóa nên khối lượng sắt tăng lên là khối lượng oxi.
=> MO = 1,41 - 1 = 0,41 g
Đặt CT oxit là FexOy
Tỉ số : \(\frac{56x}{m_{Fe}}=\frac{16y}{m_O}\Leftrightarrow\frac{56x}{1}=\frac{16y}{0,41}\Leftrightarrow\frac{x}{y}\approx\frac{2}{3}\)
=> x = 2 ; y = 3
Vậy công thức oxit là Fe2O3

| CTHH | Phân loại | Gọi tên |
| K2O | oxit bazo | Kali oxit |
| Fe2O3 | oxit bazo | Sắt (III) oxit |
| SO3 | oxit axit | Lưu huỳnh trioxit |
| N2O5 | oxit axit | Đinitơ pentaoxit |
| FeO | oxit bazo | Sắt (II) oxit |
| Al2O3 | oxit lưỡng tính | Nhôm oxit |
| Fe3O4 | oxit bazo | Sắt từ oxit |
| NO | oxit trung tính | Nitơ oxit |
| CO2 | oxit axit | Cacbon đioxit |
| P2O5 | oxit axit | Điphotpho pentaoxit |
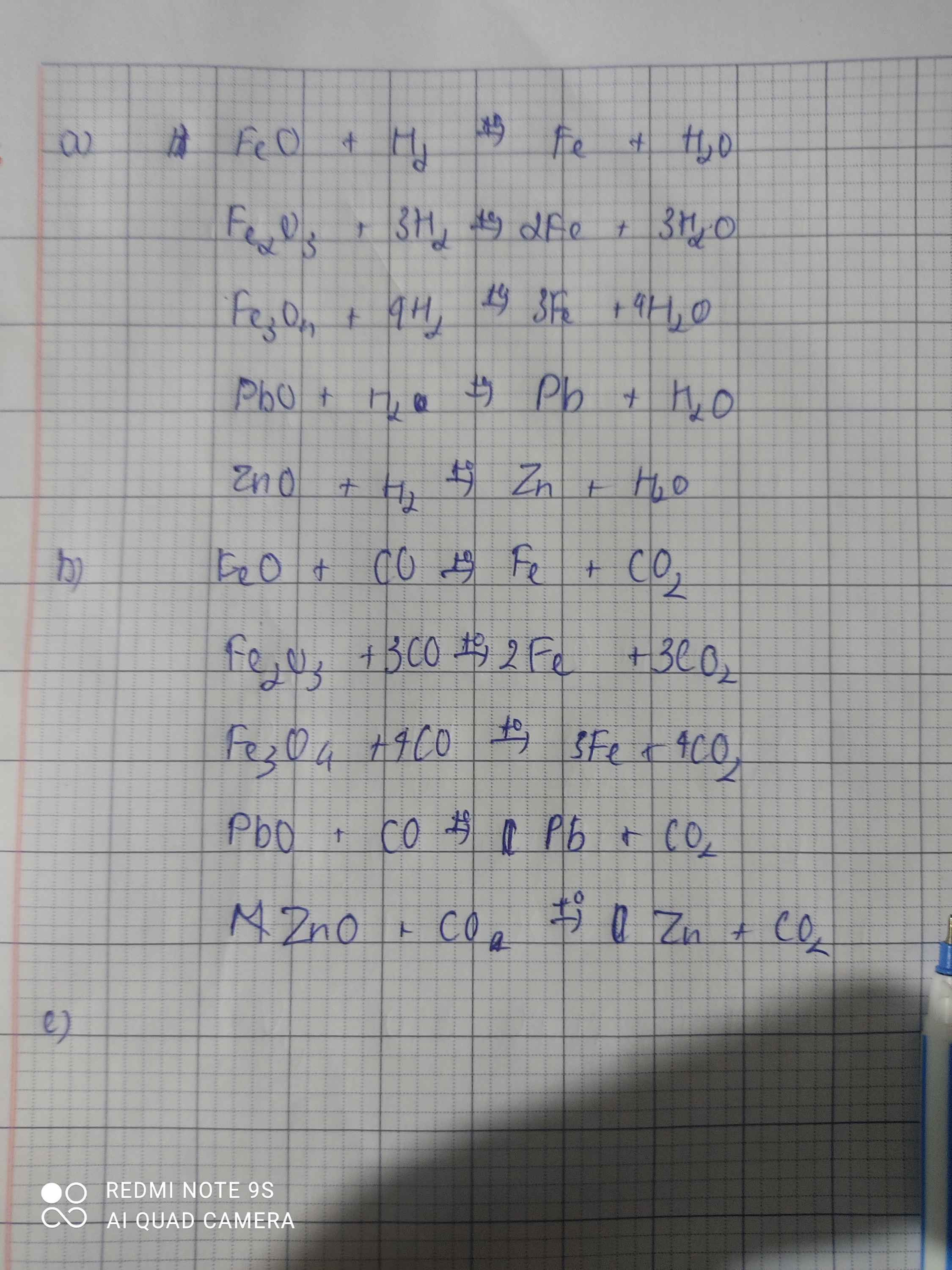
\(FeO:\%Fe=\dfrac{56}{56+16}=77,8\%\)
\(Fe_2O_3:\%Fe=\dfrac{56.2}{56.2+16.3}=70\%\)
\(Fe_3O_4:\%Fe=\dfrac{56.3}{56.3+16.4}=72,4\%\)
\(FeCO_3:\%Fe=\dfrac{56}{56+12+16.3}=48,28\%\)
ơ mây dìng,gút chóp em=))